Abstract
Background
Therapeutic efficacy of argatroban is globally not known yet because few clinical studies in acute ischemic stroke are reported and the sample sizes of these studies is small. The aim of this study is to demonstrate an efficacy and safety in patients with cerebral territory infarction who received argatroban within 48 hours from symptom onset.
Methods
This study included patients with acute cerebral territory infarction within 48 hours after stroke onset. All subjects were divided into 2 groups: those receiving argatroban on admission (argatroban group), and those receiving aspirin only (control group). We estimated the subjects’ neurologic deficits and functional outcomes by using National Institute of Health Stroke Scale (NIHSS) and modified Rankin scale (MRS) prior to argatroban infusion and aspirin administration, on first day and 10th day after initiation of the therapy.
Results
In comparison to the aspirin group, the argatroban group showed significant improvement of NIHSS and MRS among before treatment, first day and 10th day after treatment. There was a significant difference of NIHSS and MRS between the argatroban group and the control group at 10th day after initiation of the therapy, which proved superiority of the argatroban group with cerebral territory infarction within 48 hours after stroke onset.
허혈성 뇌졸중은 혈전 또는 색전등으로 인해 뇌혈관이 막혀서 뇌세포가 허혈성 손상을 받는 기전으로, 뇌세포의 영구적인 손상이 발생하기 전에 혈전을 용해시켜 혈류를 재개통 시키는 것이 가장 중요한 치료 목표다. 따라서 여러 혈전용해제 및 시술을 이용한 치료 및 임상연구가 이루어지고 있다[1]. 현재까지 급성 허혈성 뇌졸중의 가역적인 치료방법으로 미국 Food and Drug Administration (FDA)에서 인정받은 혈전용해제는 조직 플라스미노겐 활성제(tissue plasminogen activator, t-PA)가 거의 유일하다[2]. ECASS III 연구에 의하면 허혈성 뇌졸중 증상 발생 후 4.5시간까지 t-PA 치료가 가능하며, 증상 발생 6시간 이내에 동맥천자를 시작할 수 있는 경우 혈관내 치료도 시도해볼 수 있다[3,4]. 그러나 이러한 재관류 치료는 뇌출혈의 위험이 있으므로 최대한 치료로 도움이 되는 급성기 뇌졸중 환자를 빠르게 선별하는 것이 가장 중요하나 재관류 치료의 시간 제약 때문에 매우 한정적이다. 따라서 이러한 시간의 한계를 극복하면서 예후에 도움을 주는 다른 치료방법에 대한 연구들이 지속적으로 진행 중이지만 아직 뚜렷한 효과를 기대하기 어렵다[5].
허혈성 뇌졸중을 일으키는 중요 원인으로 작용하는 혈전 형성은 흔히 고혈압이나 당뇨 등 위험인자를 가진 환자에서 뇌동맥의 죽상경화로 좁아진 혈관에서 혈전이 형성되면서 발생하고, 이 과정에서 트롬빈(thrombin)은 섬유소 침착, 혈소판응집, 혈관수축 등을 일으켜 허혈 부위에 미세순환장애를 초래하고, 섬유소를 함유하는 미세혈전은 허혈 경계부위에 축적되어 뇌경색 부위를 확장시킨다[6,7]. 또한 트롬빈은 백혈구의 화학주성인자의 생성을 유도하여 염증반응을 항진시켜 뇌경색을 악화시킨다[7]. 아르가트로반(argatroban)은 1978년 Okamoto 등에 의해 개발된 아르기닌(arginine) 유도체로서 트롬빈의 활성화 부위에 직접 결합하여 촉매작용의 활성도를 억제하는 직접 트롬빈억제제이다[8]. 즉, 아르가트로반은 직접적으로 트롬빈을 억제하여 트롬빈과 관련된 혈소판 응집 및 엔도텔린-1의 유리를 억제하는 효과가 있다[6,8,9]. 일본을 중심으로 허혈성 뇌졸중 증상 발생 48시간 이내에 내원한 환자들에게 사용하고 있으며, 신경학적 증상의 심한 정도와 상관없이 아르가트로반이 급성 허혈성 뇌졸중 환자에게서 효과적이라고 보고되고 있다[10]. 미세혈전 형성은 뇌경색 부위가 확장하게 되는 중요한 기전으로 알려져 있으며, 아르가트로반이 트롬빈을 직접적으로 억제함으로써 뇌경색 부위를 확장시키는 데 중요하게 작용하는 미세혈전의 형성을 막고 반음영 부위에 혈류량을 증가시켜 신경학적 결손 정도를 경감시켜 줄 수 있으며 트롬빈에 의한 뇌혈관 수축을 억제하여 허혈 부위도 감소시킨다[8,11]. 또한 아르가트로반을 서서히 정주하였을 때 선택적으로 빠르게 트롬빈과 가역적으로 결합하여 혈액응고 및 aPTT를 안정화시키고 헤파린에 비해 응고시간 조절을 용이하게 하여 출혈성 부작용에 대한 안전성 또한 기대할 수 있다[8,12].
그러나, 아직까지 일본 이외에서는 급성기 뇌경색 치료로써 흔히 사용되고 있지 않으며 임상연구도 부족한 실정이다. 국내에서도 급성기 뇌경색의 치료에 아르가토르반의 안전성 및 효과에 대한 연구가 거의 이루어지지 않고 있다. 더욱이 영역성 뇌경색(cerebral territory infarction)의 급성기 시기에 아르가트로반의 투여로 인한 치료 효과 및 장기적인 신경학적 예후에 대한 연구는 더욱 더 시행되지 않고 있다. 따라서 본 저자들은 본 연구를 통해 증상 발생 48시간 이내에 내원한 급성기 허혈성 뇌졸중 환자 중에서 영역성 뇌경색을 가진 경우만을 선택하여 아르가트로반의 투여로 인한 임상적인 치료 효능 및 안전성을 입증하고자 한다.
본 연구는 2012년 7월부터 2014년 5월까지 본원 신경과에 급성기 허혈성 뇌졸중으로 내원한 환자를 대상으로 하였고, 확산강조영상이 포함된 뇌자기공명영상을 통해 영역성 뇌경색을 가진 환자 87명을 뇌졸중 레지스트리를 기반으로 무작위로 배정하여 본원 윤리심의위원회 승인 하에 시행하였다.
선정기준은 갑작스럽게 발생한 신경학적 증상이 6시간이 지났으나 48시간이 지나지 않은 환자로, 신경학적 증상 및 자기공명영상을 통해서 영역성 뇌경색으로 진단된 환자만을 선택하였다. 또한 혈전성 뇌경색 환자만을 선택하기 위하여 심인성 색전증이 의심되는 환자를 제외하였다. 이외에도 뇌자기공명촬 영상에서 출혈성 병변, 종양, 혈관기형, 항응고제 또는 항혈소판제를 복용하는 환자, 모야모야병, 혈관염 및 간 기능이나 신장 기능에 이상이 있는 환자도 제외하였다.
선정된 환자 총 87명에서 아르가트로반 투여군은 47명이었고, 대조군으로 아스피린을 투여한 환자군은 40명이었다. 이 중 아르가트로반 투여군은 내원 첫날과 둘째 날은 아르가트로반 60 mg을 시간당 2.5 mg으로 24시간 동안 생리식염수 1,000 mL를 혼합하여 서서히 정맥 투여하였고, 이후 5일 동안은 아르가트로반 10 mg을 생리식염수 200 mL에 혼합하여 12시간마다 각각 3시간 동안 지속적으로 정맥 투여 하였다. 이 동안은 아르가트로반 이외에 항응고제, 혈관 확장제, 섬유소 용해제 그리고 항혈소판제는 전혀 투여하지 않았다. 비교 대조군인 아스피린 그룹은 내원 첫날부터 하루에 아스피린 100 mg을 투여하였다.
각각의 대상군의 뇌졸중의 위험인자로써 고혈압, 당뇨병, 고콜레스테롤 혈증 그리고 흡연력을 비교하였다. 고혈압은 기존에 고혈압을 진단받고 치료 중이거나 2회 이상 혈압을 측정하여 수축기 혈압이 140 mmHg, 이완기 혈압이 90 mmHg 이상인 경우로, 당뇨병은 기존에 당뇨병으로 진단받았거나 공복시 혈당이 126 mg/dL 이상인 경우로, 고콜레스테롤혈증은 이전에 고지혈증으로 진단받아 치료 중인 환자들과 총 콜레스테롤이 220 mg/dL 이상인 경우로 정의하였다. 흡연에 대해서는 최근 5년간 흡연을 한 차례라도 한 경우는 흡연자로 분류하였다.
본 연구의 모든 대상군의 신경학적 증상의 변화 및 기능을 평가하기 위해서 내원 시와 치료 후 1일, 10일째의 National Institutes of Health Stroke Scale (NIHSS)과 modified Rankin scale (MRS)를 이용하여 총 3회 평가하였다. 안전성에 대한 평가는 주로 뇌출혈, 위장관 출혈, 혈뇨등 출혈성 합병증에 중심을 두었는데 대개는 임상적인 관찰에 의해 평가를 하였고 뇌출혈 여부에 대해서는 7일 이후 추적검사로 시행한 뇌전산화컴퓨터촬영을 바탕으로 평가하였다.
통계적 분석은 시간 변화에 따른 환자군 간의 신경학적 기능 평가와 각 환자별 신경학적 기능 평가에 대해서 연속 변수에 대해서는 independent t-test와 one-way ANOVA를 사용하였고, 비연속 변수에 대해서는 Chi-square 검정을 사용하여 통계 분석을 하였다. 통계 프로그램은 SPSS version 19.0 프로그램(SPSS Inc., Chicago, IL, USA)을 이용하였다.
본 연구에 참여한 모든 대상군은 총 87명으로, 남자는 58명(67%)이었고 아르가트로반 투여군 47명과 대조군(아스피린 투여군) 40명을 조사 분석하였다. 평균 연령은 아르가트로반 투여군에서 73.04±6.14, 대조군에서 74.00±6.78이었다. 모든 대상군의 기본적인 임상정보는 Table 1에 정리하였으며, 내원시 NIHSS와 MRS 그리고 허혈성 뇌졸중의 위험인자들(고혈압, 당뇨, 고콜레스테롤혈증, 흡연력)의 양 군의 비교에서는 의미 있는 차이를 보이지 않았다(Table 1).
NIHSS를 기준으로 아르가트로반 투여군과 대조군을 치료 전(내원시), 치료 후 1일 그리고 치료 후 10일째를 비교해 보았을 때, 아르가트로반 투여군은 치료 전(20.94±5.37), 치료 후 1일(18.04±6.66), 치료 후 10일(13.19±7.35)에서 각각의 NIHSS가 의미 있는 차이를 보였다(P<0.001). 그러나 대조군인 아스피린 투여군에서의 NIHSS는 내원시(19.68±5.24), 치료 후 1일(19.20±6.90), 치료 후 10일(17.25±7.30)에서 의미 있는 차이를 보이지 않았다(P=0.1). MRS 점수에 관해서는 MRS 점수 0에서 2, MRS 점수 3, MRS 점수 4 그리고 MRS 점수 5로 총 4개군으로 분류하였고, 각각의 백분율 계산하여 아르가트로반 투여군과 아스피린 대조군을 내원시, 치료 1일 후, 치료 10일 후를 비교하였다. 첫 내원 시와 치료 1일 후에는 아르가트로반 투여군과 아스피린 투여한 대조군의 의미 있는 백분율의 차이는 보이지 않았다. 이에 반해 내원 시와 치료 10일 후의 비교에서는 아르가트로반 투여군과 대조군 모두에서 MRS 점수 4와 5인 환자에서 백분율이 치료 10일 후에 감소된 소견을 보였다(Table 2, Fig. 1). 더욱이 아르가트로반 투여군에서 MRS 4와 MRS 5를 가진 환자의 백분율이 각각 21.3%에서 6.4%, 70.2%에서 29.8%로 감소를 보여 각각 32.55%에서 25%, 57.5%에서 42.5%로 감소를 보인 대조군에 비해 더 많은 호전된 양상을 보였다(Table 3, Fig. 2). 특히 MRS 4를 가진 환자의 백분율의 비교에서 대조군에 비해 MRS 4를 가진 아르가트로반 투여군은 통계적으로도 의미 있게 감소된 백분율소견을 보였다(P=0.011).
아르가트로반의 안전성에 대한 평가는 주로 출혈성 합병증에 대해서 양 군 간에 평가하였는데 아르가트로반 투여군과 대조군 모두에서 출혈성 합병증은 발생하지 않았으며 다른 심한 위장관 장애나 피부 질환 등 다른 합병증도 양 군 모두 호소하지 않았다.
본 연구에서는 증상 발생한지 6시간 이후 48시간 이내에 내원한 급성 영역성 뇌경색 환자, 즉 재관류 치료를 시도할 수 없는 신경학적 결손이 심한 영역성 뇌경색 환자들에게서 아르가트로반을 투여하는 것이 조기에 신경학적 결손을 향상시키는데 유용한 결과 여부를 밝히고자 하였다.
아르가트로반은 Okamoto 등에 의해 새롭게 합성된 저분자량의 아르기닌기 유도체로서 트롬빈의 활성화 부위에 직접 선택적으로 결합하여 촉매 작용의 활성도를 억제하는 빠르고 가역적인 직접 트롬빈 억제제이다[13,14]. 또한 그 외의 트롬빈 억제제인 헤파린과 히루딘의 경우는 아르가트로반보다 혈장 트롬빈의 억제에는 더 강력한 작용을 하나 혈괴 표면에 부착된 트롬빈에는 아르가트로반보다 작용을 하지 못하며, aPTT 연장 효과도 아르가트로반에 비해 급격하여 출혈성 부작용의 위험성도 큰 것으로 나타나 있다[14]. 또한 아르가트로반은 섬유소에 의한 혈전 형성도 억제하여 섬유소 침착 등에 의해 더 진행되는 뇌경색 영역의 확대를 막고 허혈 주변부에 혈류량을 개선시켜 신경학적 손상과 장애 정도를 개선시키는 효과도 기대하고 있다[15].
이전 아르가트로반의 임상연구에 의하면 급성 뇌혈전증에서 아르가트로반의 효과는 위약 대조군에 비해 48시간 이내에 아르가트로반이 투여되었을 때 신경학적 증상뿐만 아니라 전반적인 일상생활 수행능력까지 통계적으로 의미 있는 호전을 나타냈다고 Kobayashi와 Tazaki [12]는 보고하였다. 본 연구에서는 상기한 이전 연구와 달리 위약군 대조군 대신 아스피린 투여군을 대조군으로 하여 아르가트로반 투여의 효과를 치료 전, 치료 후 1일, 치료 후 10일째의 NIHSS와 MRS를 통해 평가하였다. 본 연구 결과 아르가트로반 투여군에서 치료 전에 비해 치료 후 10일째의 NIHSS와 MRS에서 의미 있는 호전을 보여 이전 Kobayashi와 Tazaki [12]의 보고와 동일한 결과를 나타냈다. 또한 아르가트로반 투여군과 아스피린 대조군과의 비교에 있어서도 치료 후 10일째의 NIHSS와 MRS에서 의미 있는 호전을 보여 임상적으로 내원 시보다 아르가트로반 투여 이후에 NIHSS와 MRS 점수에서 신경학적인 증상의 호전 및 일상생활 수행 능력의 호전을 보인 것은 트롬빈 생성과 프라즈민 생성이 아스피린 투여군보다 감소되어 섬유소 침착이 억제되고 혈소판 응집 및 혈관수축을 억제하여 미세순환 장애를 막아주고 이로 인하여 뇌경색 부위에 침착되어 병변 부위를 확장시키는 미세 혈전 생성이 억제되어 나타난 것이라고 추정해 볼 수 있었다. 하지만 최근의 또 다른 보고에 의하면 치료 10일 이후 아르가트로반 투여군이 아스피린 투여군보다 신경학적 호전을 보였다는 본 연구와 달리 큰동맥죽상경화증 뇌경색 환자에서 아르가트로반을 투여군과 항혈소판제제 투여군과의 퇴원시 MRS 비교에 있어서 의미 있는 차이를 보이지 않아 아르가트로반이 항혈소판제제에 비해 조기 예후에 의미 있는 차이를 보이지 않는다는 보고가 있어 이에 대한 향후 지속적인 연구가 필요하다고 생각된다[16].
또한 아르가트로반의 안전성에 대한 연구들도 같이 진행되었는데 발병 12시간 이내의 급성 뇌경색 환자에게 아르가트로반을 정맥내 투여시 고용랑 아르가트로반, 저용량 아르가트로반 그리고 대조군 사이에 30일째 출혈 발생률이 통계적으로 유의한 차이가 없었음을 보고하였고, 아스피린과 비교한 국내에서 시행한 이전 연구에서도 아스피린과 아르가트로반 모두 낮은 출혈성 합병증을 보여 안전한 약제로 평가되었다[9,17,18]. 더욱이 아르가트로반은 aPTT로 항트롬빈 효과를 모니터할 수 있다는 장점이 있고, 반감기가 39-51분으로 짧아 출혈이 발생할 경우 약물 작용의 빠른 상쇄가 가능하다는 장점이 있다[19]. 본 연구에서도 어떠한 출혈성 합병증도 보이지 않아 상기한 연구들과 동일한 안전성에 대한 결과를 보였다. 같은 항트롬빈제제 헤파린의 경우 치료 농도의 안전영역이 매우 좁기 때문에 고농도 투여시 출혈 위험성이 높다. 따라서 헤파린 50 U/kg 이상 투여시 aPTT가 급격히 상승하며 bleeding time (BT) 또한 급격하게 연장된다[20]. 이에 반해 아르가트로반은 BT의 변화도 없으며 48시간 동안 60 mg을 투여하였을 때 aPTT가 1 .53배 증가할 뿐이며 국내의 연구에서도 48시간 동안 아르가트로반 투여시 aPTT가 1.2배 정도의 증가로 보고하고 있어 헤파린보다 훨씬 안전한 항트롬빈제제로 인정받고 있다[12,16,18,20].
이와 같이 아르가트로반의 안전성을 입증하는 결과들이 나오면서, 최근에는 아르가트로반과 아스피린 또는 클로피도그렐과의 복합치료의 효과에 대한 연구 및 아르가트로반과 항혈소판제의 복합치료의 효능과 안전성에 대한 무작위대조시험도 진행되고 있다[21]. 다른 연구에서는 급성기 뇌경색 환자에서 t-PA와 아르가트로반을 함께 투여하는 것이 완전한 재관류의 완성도와 속도를 증가시켰을 뿐 아니라, 안전성에서도 t-PA만 투여한 그룹과 의미 있는 차이를 보이지 않았다는 보고가 있다[22]. 따라서 아르가트로반은 혈전 용해작용은 없지만 혈전 형성 및 혈관 수축 억제 작용으로써 48시간 이내 폐색된 큰 동맥의 재관류를 조장하여 급성기 혈전 용해와 같은 효과를 안전성과 함께 기대할 수 있으며, 이후에도 영역성 뇌경색 주변의 혈류 개선을 조장하여 병변의 진행을 예방하는 기전을 통해 신경학적 결손이나 일상생활 수행 능력에 있어 아스피린 사용보다 호전된 양상을 보였음을 이전 연구들과 본 연구를 통해서 확인할 수 있었다[12,16,18]. 이에 앞으로 신경학적 결손이 심하게 나타나는 영역성 뇌경색임에도 불구하고 발병 이후 3-4시간 이내에 혈전 용해 치료를 받지 못하는 환자가 대부분인 현실에서는 아르가트로반의 사용이 증상 발생한지 48시간 이내의 환자들에게서 혈전 용해 효과를 기대하는 유용한 치료임을 기대한다.
결론적으로 본 연구를 통해 저자들은 급성기 영역성 뇌경색이 발생한지 48시간 이내 환자들에게서 아르가트로반의 치료 효과 및 안전성을 확인하였으며, 아스피린 투여군보다 단기 예후에 있어 아르가트로반 투여군이 의미 있는 임상적인 호전을 보여 향후 영역성 뇌경색 환자의 급성기 치료에 유용하게 사용할 수 있는 항트롬빈 제제라고 평가할 수 있었다. 하지만 본 연구는 대상군이 총 87명으로 적은 수의 표본이며, 치료 후 10일째까지의 MRS와 NIHSS를 평가함으로써 비교적 단기의 급성기 뇌경색 치료 유용성을 확인하였다는 제한점을 가지고 있다. 따라서 아가트로반의 급성기 뇌경색에 대한 효능을 좀 더 명확히 밝히기 위해서는 다기관이 참여하는 아르가트로반의 치료 효과 및 장단기 예후에 대한 이중 맹검 대조군 비교연구가 필요하다.
REFERENCES
1. Rha JH, Saver JL. The impact of recanalization on ischemic stroke outcome: a meta-analysis. Stroke. 2007; 38:967–73.
2. Adams HP Jr, del Zoppo G, Alberts MJ, Bhatt DL, Brass L, Furlan A, et al. Guidelines for the early management of adults with ischemic stroke: a guideline from the American Heart Association/American Stroke Association Stroke Council, Clinical Cardiology Council, Cardiovascular Radiology and Intervention Council, and the Atherosclerotic Peripheral Vascular Disease and Quality of Care Outcomes in Research Interdisciplinary Working Groups: the American Academy of Neurology affirms the value of this guideline as an educational tool for neurologists. Stroke. 2007; 38:1655–711.
3. Hacke W, Kaste M, Bluhmki E, Brozman M, Dávalos A, Guidetti D, et al. Thrombolysis with alteplase 3 to 4.5 hours after acute ischemic stroke. N Engl J Med. 2008; 359:1317–29.

4. Berkhemer OA, Fransen PS, Beumer D, van den Berg LA, Lingsma HF, Yoo AJ, et al. A randomized trial of intraarterial treatment for acute ischemic stroke. N Engl J Med. 2015; 372:11–20.
5. Clark WM, Albers GW, Madden KP, Hamilton S. The rtPA (alteplase) 0- to 6-hour acute stroke trial, part A (A0276g) : results of a double-blind, placebo-controlled, multicenter study. Thromblytic therapy in acute ischemic stroke study investigators. Stroke. 2000; 31:811–6.
6. Heye N, Paetzold C, Cervós-Navarro J. The role of microthrombi and microcirculatory factors in localization and evolution of focal cerebral ischemia. Neurosurg Rev. 1991; 14:7–16.
7. Colotta F, Sciacca FL, Sironi M, Luini W, Rabiet MJ, Mantovani A. Expression of monocyte chemotactic protein-1 by monocytes and endothelial cells exposed to thrombin. Am J Pathol. 1994; 144:975–85.
8. Walenga JM. An overview of the direct thrombin inhibitor argatroban. Pathophysiol Haemost Thromb. 2002; 32 Suppl 3:9–14.

9. LaMonte MP, Nash ML, Wang DZ, Woolfenden AR, Schultz J, Hursting MJ, et al. Argatroban anticoagulation in patients with acute ischemic stroke (ARGIS-1): a randomized, placebo-controlled safety study. Stroke. 2004; 35:1677–82.
10. Park JS, Park SS, Koh EJ, Eun JP, Choi HY. Treatment for patients with acute ischemic stroke presenting beyond six hours of ischemic symptom onset : effectiveness of intravenous direct thrombin inhibitor, argatroban. J Korean Neurosurg Soc. 2010; 47:258–64.

11. Ikoma H. Development of argatroban as an anticoagulant and antithrombin agent in Japan. Pathophysiol Haemost Thromb. 2002; 32 Suppl 3:23–8.

12. Kobayashi S, Tazaki Y. Effect of the thrombin inhibitor argatroban in acute cerebral thrombosis. Semin Thromb Hemost. 1997; 23:531–4.

13. Hijikata A, Okamoto S, Mori E, Kinjo K, Kikumoto R. In vitro and in vivo studies of a new series of synthetic thrombin-inhibitors (OM-inhibitors). Thromb Res. 1976; 8(2 Suppl):83–9.

15. LaMonte MP. Argatroban in thrombotic stroke. Pathophysiol Haemost Thromb. 2002; 32 Suppl 3:39–45.

16. Wada T, Yasunaga H, Horiguchi H, Matsubara T, Fushimi K, Nakajima S, et al. Outcomes of argatroban treatment in patients with atherothrombotic stroke: observational nationwide study in Japan. Stroke. 2016; 47:471–6.
17. Rahbar MH, Dickerson AS, Cai C, Pedroza C, Hessabi M, Shen L, et al. Methodological issues for designing and conducting a multicenter, international clinical trial in acute stroke: experience from ARTSS-2 trial. Contemp Clin Trials. 2015; 44:139–48.

18. Song YM, Jeong SW, Bae HJ, Yoon BW, Cho KH, Lee BC, et al. Argatroban treatment in acute ischemic stroke: multicenter, randomized, aspririn-controlled study. J Korean Neurol Assoc. 2004; 22:302–9.
19. Escolar G, Bozzo J, Maragall S. Argatroban: a direct thrombin inhibitor with reliable and predictable anticoagulant actions. Drugs Today (Barc). 2006; 42:223–36.

20. Kario K, Kodama K, Koide M, Matsuo T. Thrombin inhibition in the acute phase of ischaemic stroke using argatroban. Blood Coagul Fibrinolysis. 1995; 6:423–7.

21. Nishi R, Mano T, Kobayashi Y, Matsuo K, Kobayashi Y. Argatroban, aspirin, and clopidogrel combination therapy for acute penetrating artery infarction: a pilot study. Brain Nerve. 2016; 68:181–9.
22. Barreto AD, Alexandrov AV, Lyden P, Lee J, Martin-Schild S, Shen L, et al. The argatroban and tissue-type plasminogen activator stroke study: final results of a pilot safety study. Stroke. 2012; 43:770–5.
Figure 1.
Comparison of National Institutes of Health Stroke Scale scores between Argatroban and Aspirin (control) groups.
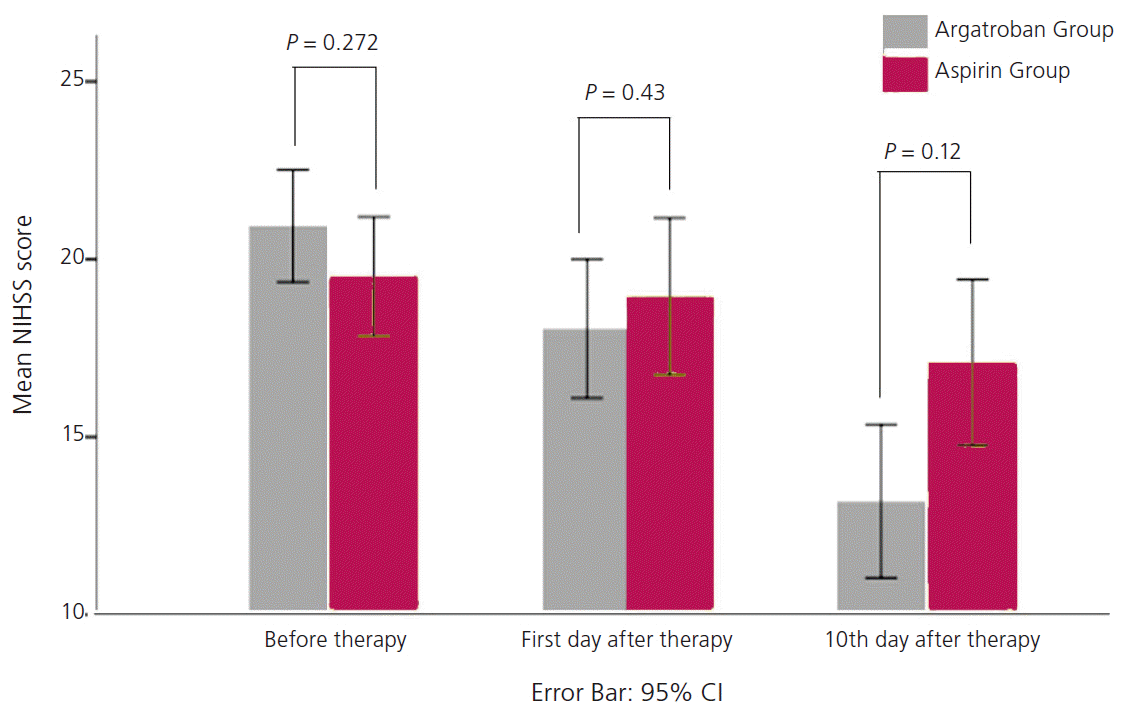
Figure 2.
Stacked Bar Graph for Comparison of the percentages of Argatroban and Aspirin (control) groups according to Modified Rankin Scale.
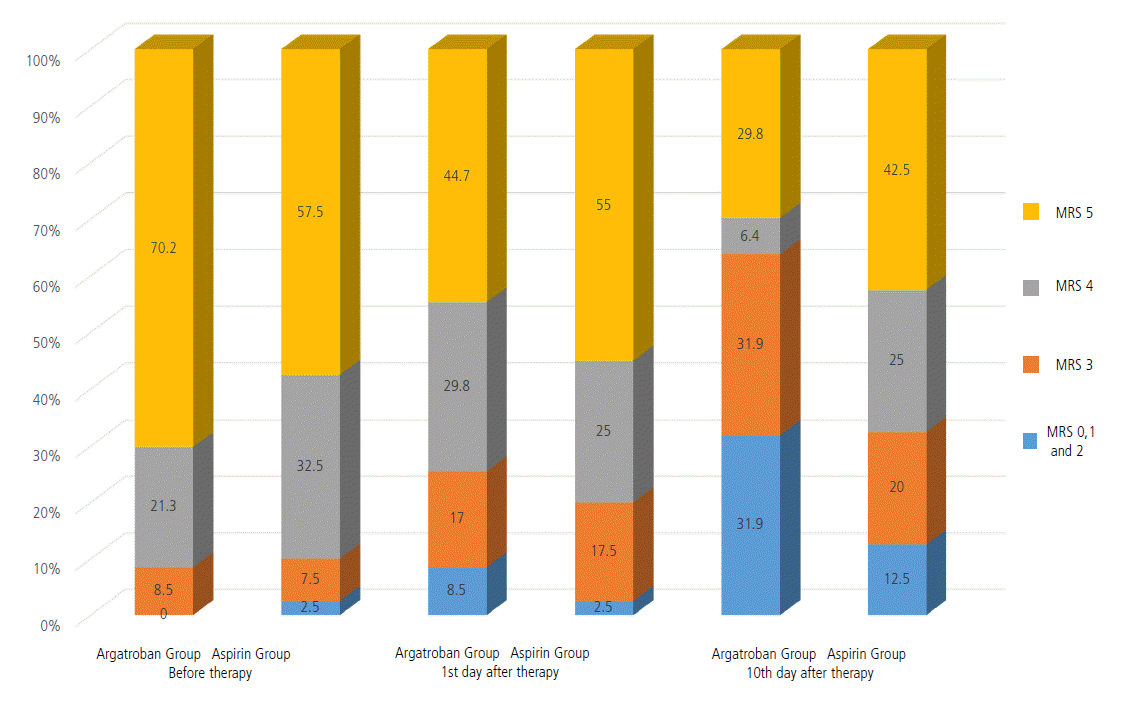
Table 1.
Baseline characteristics of the argatroban and aspirin (control) groups
Table 2.
Comparison of NIHSS between argatroban group and aspirin (control) group
| Before therapy | 1st day after therapy | 10th day after therapy | P value | |
|---|---|---|---|---|
| Argatroban group | 20.94±5.37 | 18.04±6.66 | 13.19±7.35 | <0.001* |
| Aspirin group | 19.68±5.24 | 19.20±6.90 | 17.25±7.30 | 0.1 |
| P value† | 0.272 | 0.43 | 0.012 |
Table 3.
Comparison of MRS between argatroban group and aspirin (control) group




 PDF
PDF Citation
Citation Print
Print


 XML Download
XML Download