증례: 37세 남자가 건강검진으로 시행한 대장내시경에서 우연히 발견된 종물로 내원하였다. 복통이나 혈변 등의 증상은 없었다. 과거력으로 기흉과 고지혈증이 있었다. 8갑년의 흡연력을 가지고 있었고, 술은 마시지 않았다. 수술력은 없었다. 생체활력징후는 혈압 120/80 mmHg, 맥박 72회/분, 호흡수 16회/분, 체온 36.6℃였다. 검사실 소견에서 이상 소견은 관찰되지 않았다. 대장내시경 검사에서 근위부 상행결장에 약 1.5 cm 크기의 돌출된 종물이 관찰되었고, 병변의 중앙에 약간의 함몰로 인해서 어금니 모양과 닮아 있었다(Fig. 1). 표면은 황색이었고, 과립상을 동반하였다. 조직 검사용 겸자로 눌러보았을 때에 상피 아래에 종물이 들어있는 것처럼 움직이는 로울링 징후(rolling sign)가 보였으며, 단단한 특성을 가지고 있었다. 초음파 내시경에서 점막하층에 저에코성 둥근 종물이 관찰되었으며(Fig. 2A), 불분명한 점막근층과의 경계와 함께 점막하층과의 불규칙한 경계를 보였다(Fig. 2B).
대장내시경을 통한 조직 검사에서 균일한 핵과 풍부한 호산구성 입상 세포질을 가진 큰 다각형 세포가 둥지 모양으로 뭉쳐 있는 양상으로 관찰되었으며, 면역조직화학 염색에서 S-100 염색 양성 소견과 PAS 염색에서 일부 세포질 과립에서 양성 소견을 보였다(Fig. 3A). 환자는 내시경적 절제술을 거부하고, 우측 대장 절제술을 시행하였다. 수술 검체는 1.2×1.0 cm 크기의 종물로서 수술 후의 병리 검사 소견에서도 균일한 핵과 풍부한 호산구성 입상 세포질을 가진 큰 다각형 세포가 둥지 모양으로 뭉쳐 있고, 그 사이로 유리질이 둘러싸고 있었다. 핵 대 세포질 비율의 증가는 없었고, 다형성(pleomorphism)이나 괴사 및 석회화 소견은 관찰되지 않았으며, 10개의 고배율 시야에서 유사분열 수는 0이었다. 병변은 주로 점막하층에서 관찰되며 침윤성 종양으로 인하여 점막근층은 관찰되지 않고 경계가 모호하였다. 고유점막의 침윤은 없었으나, 점막하층의 침윤성 경계를 보였다(Fig. 3B). 면역조직화학 염색에서 CD68 염색에서 양성이었고(Fig. 3C), S-100 염색에서도 양성이었다(Fig. 3D). 이후 3년간 추적 검사에서 재발은 없었다.
진단: 대장 과립세포 종양
과립세포 종양은 신경집세포(schwann cell)에서 기원하는 종양으로 우리 몸의 어디에서도 발생할 수 있으며, 연조직(soft tissue)에서 가장 흔하게 발생한다. 전체 과립세포 종양의 5-11%가 위장관에서 발견된다.1,2 위장관에서는 식도가 가장 호발 장기이며, 대장은 2번째로 흔한 장기로 알려져 있다. 위장관의 과립세포 종양의 분포는 식도가 65%, 대장이 20%, 위가 9%로 알려져 있다.2,3 대장 과립세포 종양은 맹장에서 직장까지 대장의 모든 부위에서 발생할 수 있지만, 대장 과립세포 종양의 73% 정도가 우측 대장에서 발생한다.4,5 대장 과립세포 종양은 85% 정도가 대장내시경 검사를 통하여 우연히 발견된다.2
본 증례는 우측 대장에서 발견된 대장 과립세포 종양으로 대장내시경 소견은 비교적 전형적인 양상으로 보였다(Fig. 1). 대장 과립세포 종양의 내시경 소견은 식도와 유사하게 황색 과립상의 상피하종양으로 관찰되며, 대장의 경우에 드물게 무경성 또는 유경성 용종처럼 관찰될 수도 있다. 대장 과립세포 종양이 식도보다 더 큰 경향이 있다고 알려져 있는데, 한 연구에서 대장에서의 평균 크기는 6 mm, 식도는 2.7 mm로 보고하였다.3 크기는 0.3 mm에서 4 cm까지 보고된 바 있으며, 표준적인 치료법은 아직 정해져 있지 않지만, 2 cm 미만의 종양에서 내시경을 이용하여 성공적으로 치료한 증례들이 많이 보고되었다.5,6
한편, 본 증례의 초음파 내시경 소견은 이전에 보고되었던 증례들과는 다른 양상을 보였다. 대장 과립세포 종양의 내시경 초음파 소견은 식도와 유사하다고 알려져 있고, 기존에 보고된 대장 과립세포 종양의 초음파 내시경 증례들은 주로 전형적인 식도 과립세포 종양과 비슷하게 보고되었다. 전형적인 과립세포 종양의 초음파 내시경 소견은 균질한 저에코성의 둥근 형태의 종물이 점막하층에서 부드러운 변연을 동반하여 관찰된다. 하지만, 식도 과립세포 종양도 때로는 과립형 이질적인 고에코성(granular type heterogenous hyperechoic) 병변으로 관찰되거나, 불규칙한 변연을 동반할 수 있다. 주로 점막하층에서 기원하지만, 고유근층을 침범하거나 기원할 수도 있다.7 초음파 내시경에도 불구하고 점막근판이나 고유근층에 위치한 평활근종과 감별이 어려울 수 있다.1 점막하층에서 균질한 저에코성 종물로 관찰될 때에는 신경내분비 종양과 감별이 어려울 수도 있다. 본 증례는 침습적인 변연부를 동반한 과립세포 종양이 대장 초음파 내시경 증례로, 점막근판과 점막하층의 경계는 불명확하였으며, 고유근층의 침범은 없었지만, 점막하층과 고유근층의 경계가 불규칙하게 관찰되었다(Fig. 2). 이는 병리 소견에서도 점막하층과 고유근판의 경계 부위가 불규칙한 침윤성 양상으로 확인이 되었으나, 악성을 시사하는 소견은 없었다(Fig. 3).
위장관에서 과립세포 종양은 50-83% 정도가 내시경 조직 검사로 진단 가능하며,7,8 조직 검사적 특징은 균일한 핵과 풍부한 호산구성 과립상 세포질을 가진 큰 다각형 세포들이 둥지 또는 시트(sheets) 모양으로 뭉쳐 있는 소견이다. 과립세포 종양의 진단을 위해 여러 면역조직화학 염색법이 사용되며, S-100 단백은 100%에서 양성이며, CD68은 95%, CD56은95%, SOX-10은 93%에서 양성이라고 알려져 있다.3,9,10 대장과립세포 종양도 다른 장기와 비슷한 특성을 보이며, 대장의 경우에는 식도보다 종양 주위 림프 커프(peritumoral lymphoid cuffs)와 침윤성 성장 패턴(infiltrative growth pattern)을 좀 더 동반하지만,5 악성과의 연관성은 낮다고 알려져있다.4 한 연구에서 모든 위장관 과립세포 종양에서 유리질화(hyalinization)를 동반하였고, 우측 대장의 과립세포 종양에서는 석회화(calcification) 소견도 동반할 수 있다고 보고하였다.6
양성과 악성을 나누는 분류법은 Fanburg-Smith 분류(Table 1)11와 Nasser 분류(Table 2)12의 2가지가 있다. 모든 장기에서 발생한 과립세포 종양을 분석한 체계적 문헌고찰 연구에서 Fanburg-Smith 분류에서는 양성이 60%, 비정형이 38%, 악성이 2%로 분류되었고, Nasser 분류를 이용하면 양성은 98%, 악성은 2%로 분류되었다.6 하지만, 아직까지 이 분류들을 이용하여 과립세포 종양의 생물학적 특성(biological behavior)을 평가하는 것은 제한적이며,6 조직학적으로 양성 과립세포 종양으로 진단된 환자에서도 전이가 보고된 적도 있다.13 대장 과립세포 종양에서도 악성이 보고된 바 있다.14 기존의 분류법을 본 증례에 적용하였을 때, Fanburg-Smith 분류에서는 0점으로 양성, Nasser 분류에서도 0점으로 양성으로 분류할 수 있었다.
요약하면 대장에서 발생하는 과립세포 종양은 식도보다 좀 더 침윤성 성장 패턴을 보이기 때문에 초음파 내시경에서도 불규칙한 경계로 관찰될 수 있지만, 악성과의 연관성은 명확하지 않다.
REFERENCES
1. Chen WS, Zheng XL, Jin L, Pan XJ, Ye MF. 2014; Novel diagnosis and treatment of esophageal granular cell tumor: report of 14 cases and review of the literature. Ann Thorac Surg. 97:296–302. DOI: 10.1016/j.athoracsur.2013.08.042. PMID: 24140217.

2. Johnston J, Helwig EB. 1981; Granular cell tumors of the gastrointestinal tract and perianal region: a study of 74 cases. Dig Dis Sci. 26:807–816. DOI: 10.1007/BF01309613. PMID: 6169495.

3. An S, Jang J, Min K, et al. 2015; Granular cell tumor of the gastrointestinal tract: histologic and immunohistochemical analysis of 98 cases. Hum Pathol. 46:813–819. DOI: 10.1016/j.humpath.2015.02.005. PMID: 25882927.

4. Na JI, Kim HJ, Jung JJ, et al. 2014; Granular cell tumours of the colorectum: histopathological and immunohistochemical evaluation of 30 cases. Histopathology. 65:764–774. DOI: 10.1111/his.12487. PMID: 25040719.

5. Singhi AD, Montgomery EA. 2010; Colorectal granular cell tumor: a clinicopathologic study of 26 cases. Am J Surg Pathol. 34:1186–1192. DOI: 10.1097/PAS.0b013e3181e5af9d. PMID: 20661017.

6. Mobarki M, Dumollard JM, Dal Col P, Camy F, Peoc'h M, Karpathiou G. 2020; Granular cell tumor a study of 42 cases and systemic review of the literature. Pathol Res Pract. 216:152865. DOI: 10.1016/j.prp.2020.152865. PMID: 32089415.

7. Zhong N, Katzka DA, Smyrk TC, Wang KK, Topazian M. 2011; Endoscopic diagnosis and resection of esophageal granular cell tumors. Dis Esophagus. 24:538–543. DOI: 10.1111/j.1442-2050.2011.01197.x. PMID: 21539675.

8. Palazzo L, Landi B, Cellier C, et al. 1997; Endosonographic features of esophageal granular cell tumors. Endoscopy. 29:850–853. DOI: 10.1055/s-2007-1004320. PMID: 9476769.

9. Goldenberg SP, Wain SL, Marignani P. 1990; Acute necrotizing esophagitis. Gastroenterology. 98:493–496. DOI: 10.1016/0016-5085(90)90844-Q. PMID: 2394344.

10. Kurtin PJ, Bonin DM. 1994; Immunohistochemical demonstration of the lysosome-associated glycoprotein CD68 (KP-1) in granular cell tumors and schwannomas. Hum Pathol. 25:1172–1178. DOI: 10.1016/0046-8177(94)90033-7. PMID: 7959661.

11. Fanburg-Smith JC, Meis-Kindblom JM, Fante R, Kindblom LG. 1998; Malignant granular cell tumor of soft tissue: diagnostic criteria and clinicopathologic correlation. Am J Surg Pathol. 22:779–794. DOI: 10.1097/00000478-199807000-00001. PMID: 9669341.
12. Nasser H, Ahmed Y, Szpunar SM, Kowalski PJ. 2011; Malignant granular cell tumor: a look into the diagnostic criteria. Pathol Res Pract. 207:164–168. DOI: 10.1016/j.prp.2010.12.007. PMID: 21282016.

13. Ordóñez NG, Mackay B. 1999; Granular cell tumor: a review of the pathology and histogenesis. Ultrastruct Pathol. 23:207–222. DOI: 10.1080/019131299281545. PMID: 10503740.
14. Kahng DH, Kim GH, Park DY, et al. 2013; Endoscopic resection of granular cell tumors in the gastrointestinal tract: a single center experience. Surg Endosc. 27:3228–3236. DOI: 10.1007/s00464-013-2899-2. PMID: 23479255.

Fig. 1
Colonoscopy findings. A 1.5 cm-sized protruding mass with a yellow granular surface can be seen in the proximal ascending colon. The mass resembles a molar tooth due to a slight depression in the center.
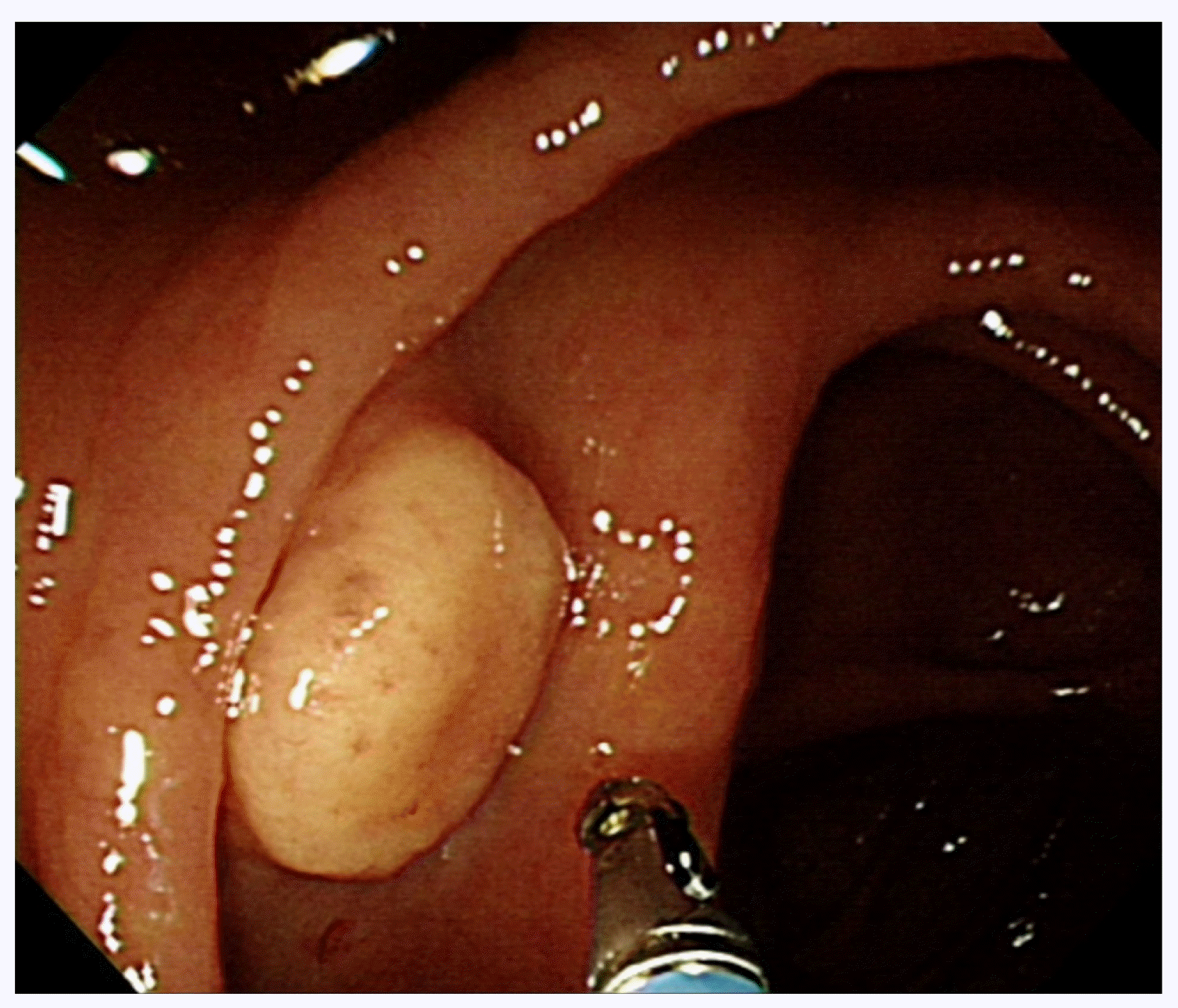
Fig. 2
Endoscopic ultrasound findings of a granular-type heterogeneous hypoechoic lesion in the submucosal layer. The bold arrow indicates an irregular border with the submucosal layer.
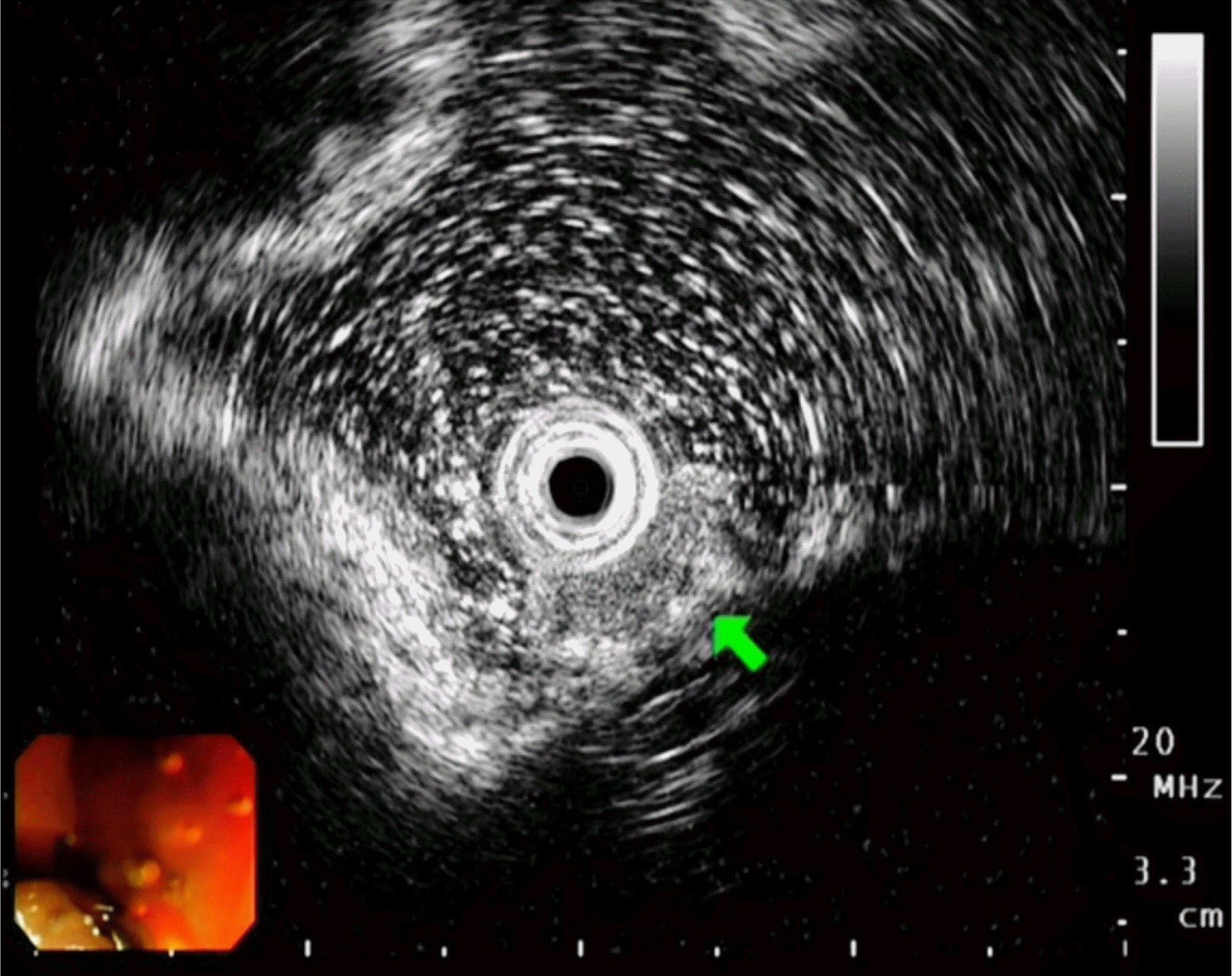
Fig. 3
(A) Histology findings of a colonoscopic biopsy. Nests of large polygonal cells with abundant eosinophilic granular cytoplasm are shown (S-100 stain, ×100). (B) Postoperative pathology findings of nests of large polygonal cells with abundant granular eosinophilic cytoplasm and hyalinization in the submucosal layer (hematoxylin and eosin stain, ×40). (C) CD 68 staining (×40) was positive. (D) S-100 staining (×40) was positive.

Table 1
Criteria for Differentiating Benign and Malignant Granular Cell Tumors: Fanburg-Smith Criteria11
Table 2
Criteria for Differentiating Benign and Malignant Granular Cell Tumors: Nasser Criteria12
| Nasser Criteria | Yes | No |
|---|---|---|
| Necrosis | 1 | 0 |
| Mitoses | 1 | 0 |




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download