This article has been
cited by other articles in ScienceCentral.
Abstract
Purpose
This study aimed to describe the surgical outcomes of bacterial infection of the finger bone and joint.
Methods
We retrospectively reviewed 31 cases of finger bone and joint bacterial infection from December 2016 to December 2019. Demographic information, finger infection details, treatment details, and range of motion (ROM) at the last follow-up were analyzed.
Results
Twenty (64.5%) of the 31 cases showed normal values in preoperative erythrocyte sedimentation rate and C-reactive protein level. Staphylococcus aureus (15 cases) was the most common pathogen. For the initial operative treatments, 21 cases were treated with incision and debridement with bone curettage or drilling, and seven with amputation. Seventeen patients underwent delayed wound closure after the initial surgery, of whom 16 did not have recurrent infections after wound closure. The mean number of operations was 2.1±1.3 in all cases. The median ROM of the involved finger was 57.7% (range, 26.9%–76.9%) and 88.8% (range, 34.6%–100%) of the contralateral side in the patients with and without initial septic arthritis, respectively (p=0.002). Twenty-nine cases (93.5% of 31 cases) showed no infection recurrence after completion of the treatments.
Conclusion
Combined antibiotic and surgical treatments showed a high cure rate, but initial septic arthritis was a poor prognostic factor of ROM. The soft tissue condition of the involved finger is important for deciding the surgical treatment method.
Keywords: Fingers, Osteomyelitis, Infectious arthritis, Amputation, Arthrodesis
서론
뼈와 관절 감염의 치료 개념은 지난 수십 년 동안 발전해 왔고, 오늘날에는 정형외과, 감염내과, 영상의학과 등의 다학제적 접근을 통한 치료가 표준이 되고 있다[
1]. 뼈와 관절 감염은 크게 항균제를 이용한 내과적 접근과 해당 부위 제거를 위한 외과적 접근을 통해 치료할 수 있다. 병변의 상태에 따라 두 가지 중 하나의 방법으로 치료할 수도 있지만, 대부분의 경우 두 가지 방법을 병행하여 치료한다[
2]. 감염원으로는 세균, 세균이기는 하지만 다른 경과를 보이는 결핵균, 혹은 비항산성 결핵균, 곰팡이 등이 고려될 수 있고, 그 중 세균에 의한 감염이 가장 흔한 것으로 알려져 있다[
3-
7]. 현재까지 뼈와 관절에 발생한 세균성 감염의 치료 원칙과 그 결과들은 상완골, 경골, 척추 등과 같은 큰 뼈와 고관절, 슬관절 등과 같은 큰 관절 등에서 주로 보고되었고, 수부 뼈와 관절의 감염에 대한 치료법과 그 결과에 대한 연구는 많지 않은 실정이다[
1].
수부는 피부와 건, 인대 등의 연부 조직이 뼈 및 관절과 매우 근접하여 연부 조직 감염이 인접한 뼈 및 관절로 이환될 수 있는 특징을 지니고 있고, 임상적으로 연부 조직만의 감염과 뼈 및 관절의 감염을 명확히 구분하기 어려운 경우도 많다[
7]. 또한 신체에서 가장 말단부에 위치하고 빈번하게 사용되어 외상에 취약하고[
8-
13], 말초 혈액 순환 장애가 있을 경우 경구용 혹은 정주용 항생제가 병변까지 잘 도달하지 않을 수 있다. 이로 인해 감염이 비교적 빈번히 발생할 수 있고, 연부 조직 감염이 뼈 및 관절의 감염으로 진행할 수 있으며, 뼈 및 관절의 감염까지 진행한 경우에는 단독 항생제 치료에 잘 반응하지 않을 수 있다.
본 연구에서는 단일 의료기관에서 발생한 세균성 수지 골 및 관절 감염의 수술 치료 결과를 후향적으로 분석하여 감염의 형태, 원인, 원인균 등을 확인하고 수술 치료 방법 및 결과를 평가하여 예후에 미치는 요인에 대해 알아보고자 한다.
대상 및 방법
이 연구는 서울아산병원 임상심의위원회(Institutional Review Board)의 승인을 받아 후향적으로 시행되었고(No. 2020-0692), 환자로부터의 연구동의서는 면제되었다. 2016년 12월부터 2019년 12월까지 단일 의료기관에서 수지 골 및 관절 감염으로 진단받고 수술적 치료를 시행한 환자들 중 원인인 특정 세균이 배양 검사에서 동정되고 수술 및 항생제 치료 완료 후 최소 3개월 이상 추시된 환자 30명(31수지)을 대상으로 연구를 진행하였다. 평균 추시 기간은 치료 완료 후 7.5개월(범위, 3–21개월)이었고 남자가 13예, 여자가 18예였으며, 평균 연령은 61세(범위, 27–84세)였다.
수지 골 및 관절의 감염은 임상 소견, 혈액학적 검사, 영상 소견 등을 토대로 판단하였고, 세균성 감염 여부는 배양 검사 결과를 토대로 확정하였다. 골절, 염좌, 인대 손상 등을 유발한 만한 강한 외상력이 없으면서 해당 수지에 국한되어 동통, 발적, 부종, 관절 운동 범위 제한 등이 있을 경우 수지 감염을 강력히 의심하여 혈액학적 검사 및 단순 방사선 촬영을 시행하였다. 단순 방사선 소견에서 뼈 및 관절을 침범한 소견이 확인되거나 해당 증상의 지속 기간이 오래된 경우, 타 병원에서 연부 조직 감염으로 판단하여 항생제 치료를 하였음에도 불구에도 증상이 호전되지 않은 경우에는 수지 골 및 관절의 감염이 동반되었을 것으로 판단하여 조영제 증강 자기공명영상 촬영을 진행하였다.
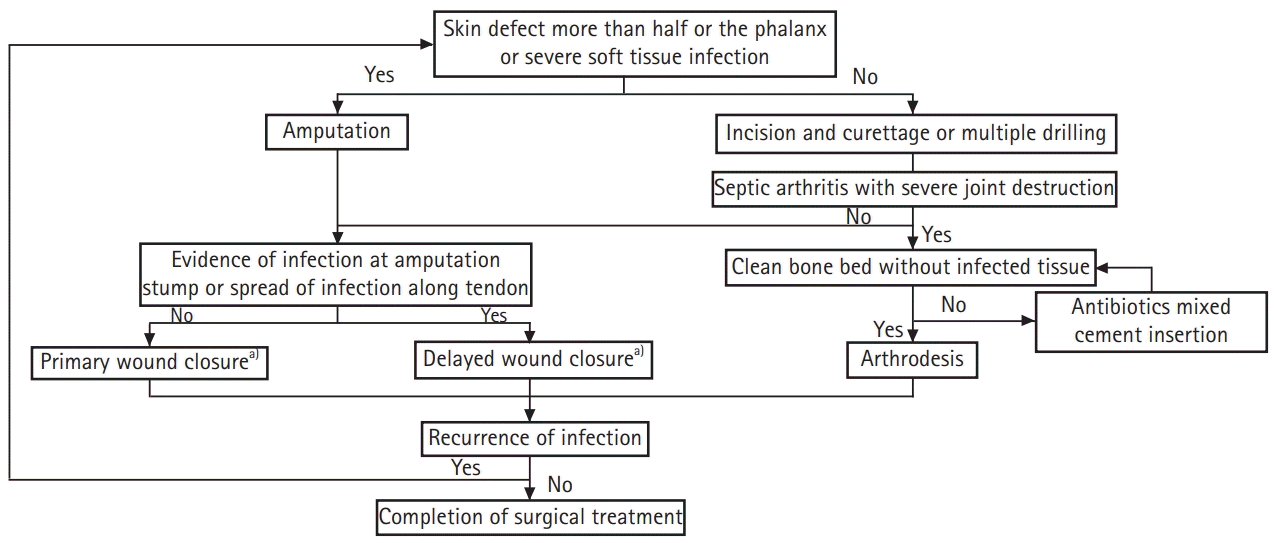
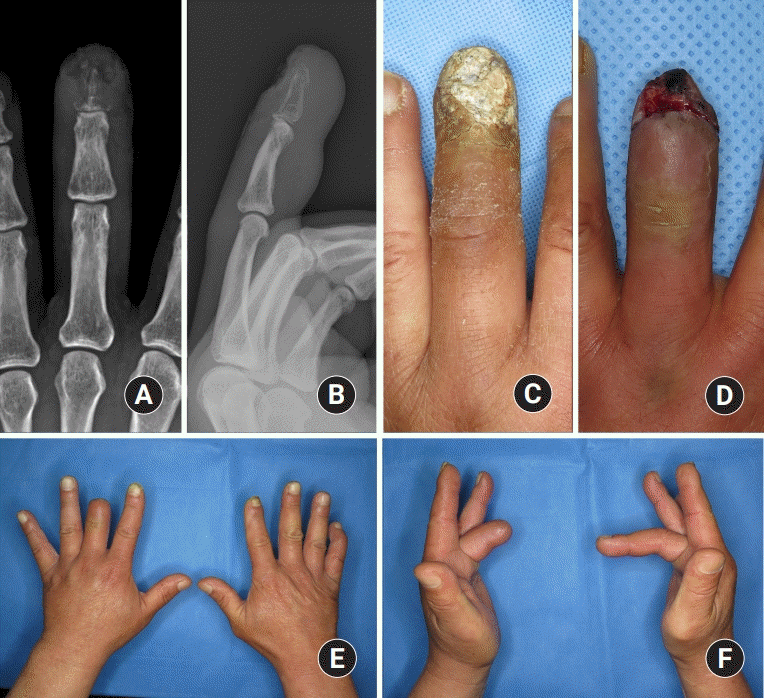
수지 골 및 관절의 감염이 확인된 환자에서는 가능한 빠른 시기에 수술 치료를 시행하였다. 일반적으로 국소 마취 하에 수술 장갑을 이용하여 제작한 손가락 토니켓(tourniquet)을 적용하여 수술을 진행하였으나 병변이 수지의 근위 지절 근위부에 위치하여 손가락 토니켓을 적용하기 어렵거나 수술 시간이 길어질 것으로 판단된 경우에는 상완 신경총 마취 하에 상완에 적용한 토니켓에 압력을 가한 후 수술을 시행하였다. 수술은 환자의 상태에 따라 크게 두 가지 방법으로 나누어서 진행하였다(
Fig. 1). 병변 측 수지의 해당 지절 표면 절반 이상의 연부 조직 결손이 있거나 심각한 감염으로 수 차례의 변연 절제술을 통하더라도 연부 조직의 회복이 불가능할 것으로 판단된 환자에서는 초기부터 수지 절단술을 시행하였다. 수술 소견에서 절단단에 감염의 증거가 없을 경우 일차 봉합을 시행하였고, 절단단에 감염이 남아 있을 것으로 의심되거나 수술 전 원위부와 연결된 건을 통한 감염의 근위부로의 전파가 의심된 경우에는 수일 간 창상을 열어둔 채로 daily soaking dressing을 시행 후 이차 봉합을 하였다. 위 방법보다 더 많은 증례에서는 일반적으로 자기공명영상에서 확인되는 뼈 및 관절의 감염 부위를 절개하여 변연 절제술을 시행하였다. 이 때 육안으로 감염이 의심되는 조직은 뼈, 연골 등을 포함하여 최대한 제거하였고, 육안으로 의심되지는 않지만 자기공명영상에서 조영 증강이 되는 뼈 부분에 대해서는 배농이 용이하도록 Kirschner 강선을 이용하여 다발성 천공술을 시행하였다[
14,
15]. 변연 절제술 후 뼈 및 연골의 결손이 심하여 연부 조직 상태 및 수지 길이 유지에 영향을 줄 수 있다고 판단된 경우에는 결손 부위를 골 시멘트(Palacos 40 g; Zimmer Biomet, Warsaw, IN, USA)와 항생제(Vancomycin 1 g; CJ Healthcare, Seoul, Korea)를 섞어서 채웠다. 변연 절제술을 시행한 경우에도 연부 조직 상태가 좋고 감염의 지속 기간이 짧으며 수술실 소견에서 감염이 심하지 않은 경우에는 일차 봉합을 시행하였고, 연부 조직 상태가 좋지 않고 감염 지속 기간이 길며 심각한 감염이 확인된 경우에는 daily soaking dressing을 시행한 후 이차 봉합을 하였다. 봉합 후 경과 관찰 도중 창상이 좋지 않거나 동통, 발적, 부적, 관절 운동 범위 제한 등의 증상이 악화되거나 재발한 경우에는 감염이 조절되지 않은 것으로 판단하고, 위에 기술한 과정대로 수술을 재시행하였다. 수지의 강직을 예방하기 위해 창상이 개방된 상태에서도 수술 직후 수동 및 능동 관절 운동을 독려하였고, 창상을 봉합한 이후에도 봉합 후 2, 3일 경과 후부터 지속적인 관절 운동을 교육하였다[
16]. 절단을 시행한 경우에도 남은 관절의 관절 운동을 초기부터 적극적으로 독려하였다.
항생제는 배양 결과 검사를 토대로 감염내과와 상의하여 시작하였다. 수술 시의 세균 배양 검사의 양성률을 높이기 위해 외부 병원에서 세균이 동정된 경우라도 기존의 경구용 혹은 정주용 항생제를 투약 중인 환자들은 내원 이후 항생제를 중단하게 하였다. 빠른 수술이 수지 기능 보존을 위해 중요하다고 판단하여 내원일로부터 최대한 빠른 일정으로(0–4일) 수술적 치료를 시행하였다[
2,
17]. 수술 전 예방적 항생제 또한 투약하지 않았다. 수술 치료 후, 외부 병원에서 세균이 동정되었던 환자는 그 결과를 토대로 항생제를 선정하여 바로 투약을 시작하였지만 그렇지 않은 경우는 본원에서의 세균 배양 검사 결과가 나올 때까지 항생제를 투약하지 않았고, 세균 검사 결과에 따라 항생제를 투약하였다[
2]. 항생제 투약 기간은 기본적으로 4–6주 이상 사용하려고 하였고 정주용 항생제가 있는 경우는 정주용 항생제를 우선 사용하였으며 감염이 심하지 않거나 경구용 항생제가 있는 경우에는 정주용 항생제를 경구용으로 바꾸거나 경구용 항생제만을 사용하였다. 초기에 절단을 시행한 경우에는 절단 후 바로 창상 봉합을 했을 때는 항생제를 2주 미만으로, 지연성으로 봉합했을 때는 4주 미만으로 사용하였다. 상기 원칙들을 바탕으로 치료하였지만 항생제의 종류 및 기간은 균의 종류, 창상의 상태, 환자의 전신 상황 등을 고려하여 감염내과와 상의하여 개인별로 구분하여 적용하였다.
수술 후 일주일에 2회 이상 혈액 검사를 시행하였고 일주일에 1회 이상 단순 방사선 촬영을 시행하였다. 가장 최근 추시 시에 해당 수지의 관절 운동 범위를 측정하였고, 근위 및 원위 지간 관절, 중수 수지 관절의 관절 운동 범위의 합이 건측에 비해 어느 정도인지 평가하였다. 절단술을 시행한 환자에서는 절단된 관절의 운동 범위를 0으로 간주하고 남은 관절의 관절 운동 범위만을 측정하여 평가하였다.
통계적 분석은 IBM SPSS Statistics ver. 20.0 (IBM Corp., Armonk, NY, USA)을 사용하였다. 기술적 통계 분석은 기본적으로 평균과 표준 편차를 이용하여 표기하였고, 정규성 검정 후 정규 분포를 하지 않은 경우에는 중앙값과 범위로 표기하였다. 증상 발생 후 본원에서의 수술 치료 시기까지의 기간이 최종 절단 및 관절 고정술 시행에 미치는 영향에 대해서는 Fisher의 정확성 검정을 이용하여 분석하였고, 초기 세균성 관절염의 유무가 수지의 최종 관절 운동 범위에 미치는 영향은 Mann-Whitney U-test를 이용하여 평가하였다.
결과
총 31예 중, 좌측이 15예, 우측이 16예였고 발생한 수지는 1수지 9예, 2수지 4예, 3수지 11예, 4수지 6예, 5수지 1예였다. 증상 발생일로부터 본원에서 수술 치료를 받기까지의 기간은 평균 2.8±1.8개월(범위, 0–13개월)이었다. 본원에서 수술 전 시행한 혈액 검사에서 평균 적혈구침강속도(erythrocyte sedimentation rate, ESR)는 25.1±29.2 mm/hour, 반응성 단백질 수치(C-reactive protein, CRP)는 0.9±2.3 mg/dL였고, 총 20예(31예 중 64.5%)에서 두 수치 모두 정상 범위였다(
Table 1). 발병 원인으로는 좌상, 관통상, 찰과상 등 수지의 외상에 의한 것이 7예로 가장 흔하였고, 그 밖에 당뇨손(4예), 내고정물에 의한 피부 자극으로 인한 감염(2예), 침 시술 후 부작용(2예), 연부 조직 수술 후 감염(2예), 류마티스 관절염으로 변형된 관절 돌출에 의한 피부 자극으로 인한 감염(2예), 허혈성 괴사(2예), 외부 물질(1예) 등이 발병 원인이었으며, 9예는 환자가 기억할 만한 선행 원인 없이 발생하였다. 확인된 원인균은 매우 다양하였는데
Staphylococcus aureus가 15예로 가장 흔하였고
Staphylococcus epidermidis를 포함한 coagulase-negative staphylococci는 10예,
Pseudomonas species가 6예에서 확인되었다(
Table 2). 총 8예(31예 중 25.8%)에서는 서로 다른 두 가지 이상의 균이 동정되었다.
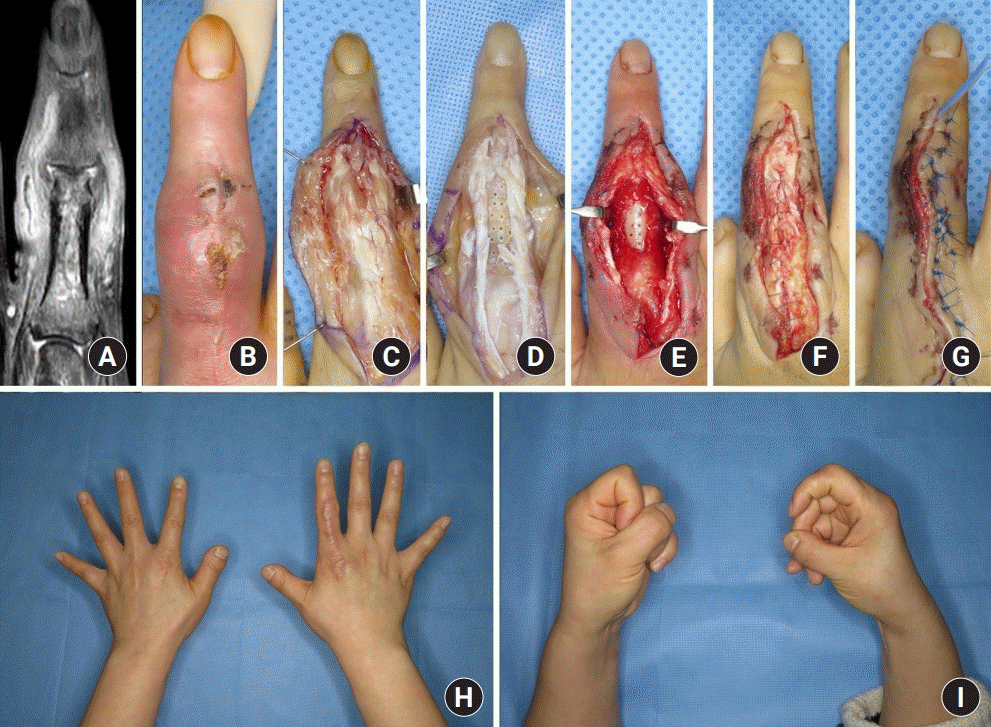
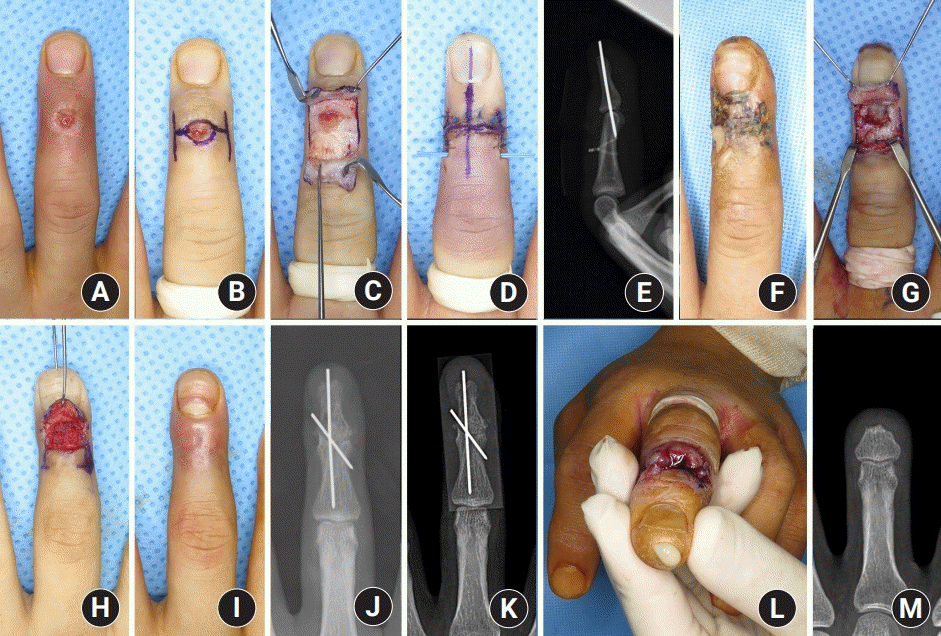
최초 수술 방법으로는 변연 절제술 및 골 소파술 혹은 골 천공술이 21예로 가장 흔하게 시행되었다. 이 중 4예는 변연 절제술 및 골 소파술 혹은 골 천공술 후 바로 창상 봉합을 하였고 12예는 지연성으로 창상을 봉합하였다(
Figs. 2,
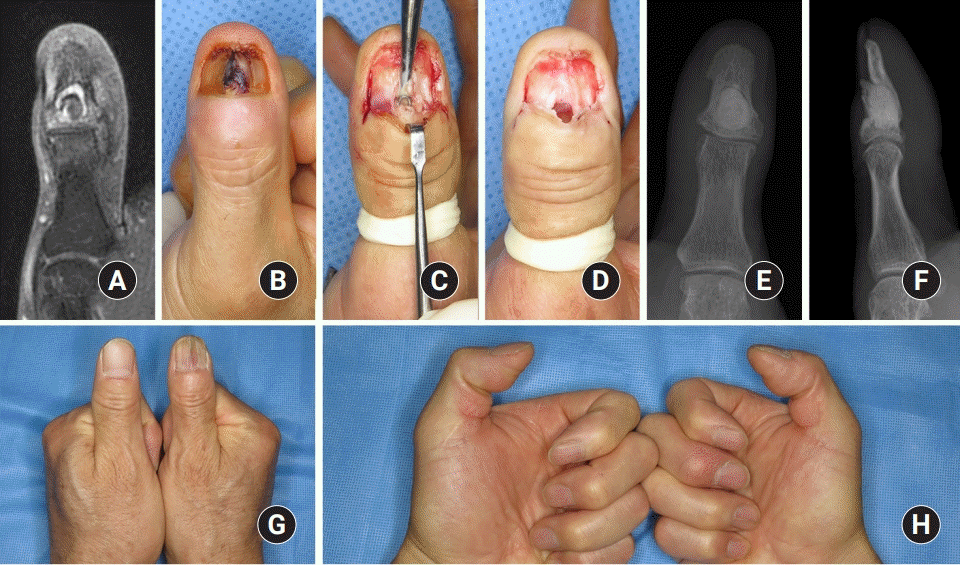
3). 나머지 5예는 궁극적으로 절단술을 시행하였다(
Fig. 4). 총 7예에서는 최초 수술 방법으로 절단술을 시행하였는데, 이 중 2예는 절단술 후 바로 창상 봉합을 하였고 5예는 지연성으로 창상을 봉합하였다(
Fig. 5). 그 밖에 총 2예에서는 최초 수술 방법으로 변연 절제술 및 골 소파술 후 관절 고정술을 시행하였고, 1예에서는 변연 절제술 및 골 소파술, 항생제와 섞은 골 시멘트 삽입술 후 관절 고정술을 시행하였다. 최초 수술 후 지연성 창상 봉합을 한 총 17예 중 16예(94.1%)에서 감염의 재발 없이 단 2회의 수술만을 시행하였다. 모든 환자의 평균 수술 횟수는 2.1±1.3회(범위, 1–8회)였다. 결과적으로 31예 중 29예(93.5%)에서 수술 치료 종결 후 감염이 재발하지 않았다(
Table 3).
증상 발생 후 본원에서 최초 수술 시까지의 기간을 3개월을 기준으로 구분하였을 때[
18], 총 31예 중 증상 발생 3개월 이전에 수술 치료를 시행한 경우가 23예, 3개월 이후에 수술 치료를 시행한 경우가 8예였다. 두 군 사이에 나이, 성별 등 인구학적인 특징의 차이는 없었다. 수지의 절단 및 관절 고정술 등 관절을 보존하지 못하게 된 비율을 확인하였을 때 두 군 간의 유의미한 차이는 없었고(43.5% vs. 50.0%, p=0.534), 최종 수술 후 재발한 예는 오히려 증상 발생 3개월 이전에 수술을 시행한 2예였다.
류마티스 관절염으로 인해 감염 전 해당 관절의 관절염이 심각하였던 2예를 제외한 29예에서 관절 운동 범위를 측정하였다. 절단하여 제거된 관절의 관절 운동 범위를 0으로 하였을 때 해당 수지의 평균 관절 운동 범위는 정상의 68.9%±22.0%였다. 최종적으로 절단을 시행하지 않은 15수지의 관절 운동 범위의 중앙값은 정상의 84.6% (범위, 42.1%–100%), 절단 혹은 관절 고정술을 시행한 14수지의 관절 운동 범위의 중앙값은 정상의 57.7% (범위, 26.9%–73.1%)였다. 감염의 관절 침범 여부를 토대로 구분하였을 때, 초기 관절 침범 15예와 그렇지 않은 14예 사이에 나이, 성별 등 인구학적인 특징의 차이는 없었고, 초기 관절 침범군에서 그렇지 않은 군에 비해 절단, 관절 강직 등으로 인해 관절 운동 범위가 유의미하게 작았다(중앙값, 57.7% [범위, 26.9%–76.9%] vs. 중앙값, 88.8% [범위, 34.6%–100%], p=0.002). 한편, 연부 조직 결손 및 상태 악화로 초기에 절단술을 시행한 7예의 절단 관절을 제외한 관절 운동 범위의 중앙값은 정상의 78.9% (범위, 52.6%–100%)였다.
고찰
수지 골 및 관절 감염은 매우 드문 질환으로, 수부 감염의 약 1%에서 18% 정도로 알려져 있다[
7,
10,
19,
20]. 수지 골 및 관절 감염은 다양한 원인으로 발생하는데, 본 연구에서는 수지의 외상으로 인한 감염이 7예로 가장 흔한 원인이었고 기존의 연구 결과와 다르지 않았다[
1,
7]. 다양한 균이 감염을 일으킬 수 있지만 환자의 발병 원인을 확인하는 것은 감염균을 추정해보는 데 도움이 된다. 외상으로 인한 감염에서는
S. aureus나 그람 음성(gram-negative)균 등에 의해 발생한다고 알려져 있고[
16], 어류 및 해수를 접촉하는 환경에서는
Vibrio균 등에 의한 감염이 발생할 수 있다고 알려져 있다[
1]. 경험적 항균제 선택 시에는 발생 가능한 감염균에 최대한의 항균력을 갖는 약제를 선택해야 하므로 병력을 청취하는 과정이 매우 중요하다고 하겠다. 본 연구에서도 외상이 선행 원인으로 가장 흔하였고,
S. aureus에 의한 감염이 15예로 가장 흔하였다.
감염이 발생하였을 때 혈액 검사에서 염증 수치인 ESR 및 CRP 등이 일반적으로 상승하지만 이번 연구에서는 전체 31예 중 20예인 64.5%의 환자에서 두 수치 모두가 정상 범위였다. 이러한 결과에 여러 원인이 작용할 수 있지만 20예 중 14예에서 본원 내원 전 타 병원에서 항생제를 치료받은 과거력이 있었으므로, 가장 큰 원인은 검사 당시의 항생제 복용력과 관련이 있는 것으로 판단된다. 골수염 치료에 있어 확정적인 세균 검사 이전에 경험적 항생제를 시작할 경우 세균 배양 검사 및 혈액 염증 검사에서 위음성 가능성이 있으므로, 임상적으로 허용할 수 있다면 배양 검사 결과가 나올 때까지 항생제 사용을 1, 2주 늦추는 것이 좋다는 보고 또한 이러한 결과를 뒷받침한다[
2,
17]. 따라서, 수술 전 염증 수치가 정상 범위라고 해서 수지 골 및 관절 감염을 완전히 배제할 수 없다는 점을 인지하고, 환자의 임상 소견과 종합하여 판단하여야 한다.
저자들은 환자의 내원 당시 연부 조직 상태를 기준으로 조기의 절단술 시행 여부를 판단하였다. 이러한 환자들에게 조기 절단술을 시행하지 않고 반복된 변연 절제술 후 필요 시 피판술 등을 시행하여 연부 조직 회복을 도모할 수 있겠지만, 이러한 경우 치료 기간과 항생제 복용 기간이 길어져 전신적인 합병증이 발생할 수 있고, 해당 관절뿐 아니라 원위 혹은 근위 관절, 더 나아가 인접 수지의 관절 운동 장해가 발생할 수 있다고 판단하였다. 실제로 조기 절단술을 시행한 7예 중 2예는 남은 관절의 운동 범위가 건측과 같았고, 다른 3예는 건측의 75% 이상이었다.
저자들은 전체 31예 중 17예(54.8%)에서 처음 수술 후 바로 창상 봉합이 아닌 지연성 창상 봉합술을 하였다. 그 이유는 첫째, 최초 수술만으로 감염 조직이 충분히 제거가 되지 않을 가능성이 있기 때문이다. 감염된 조직의 수술 치료에 있어 이상적으로는 절단을 하거나 광범위 절제술이 필요한 경우에도 현실적으로는 수지의 기능까지 고려하여 변연 절제술을 시행하므로 감염 조직이 충분히 제거되지 않을 가능성이 있다. 이에 열어둔 상처를 시간을 두고 꾸준히 세척하여 감염 조직의 충분한 제거를 도모하였다. 둘째, 연부 조직 상태가 좋지 않기 때문에 일차 봉합술 시 피부 연부 조직을 조작하고 봉합하는 과정에서 조직에 추가적인 손상을 줄 위험이 있어 창상 치유에 불리할 수 있기 때문이다. 셋째, 저자들은 균 동정 결과가 나오지 않은 상태에서는 항균제를 쓰지 않았는데, 균 동정 시까지 항균제를 사용하지 않게 되므로 일차 봉합을 하게 되면 감염 재발의 위험이 있다고 판단하였다. 그 결과 총 17예 중 16예에서 단 2회의 수술 만으로 감염이 조절되었으며, 16예 모두 이후 감염이 재발하지 않았다.
수지 골 및 관절 감염의 치료 결과에 있어 과거 연구들은 약 88%에서 100%의 높은 완치율을 보고하였으나[
11,
21,
22], 20%에서 30% 가량의 환자들은 합병증이 있었다. 그 중 해당 수지의 강직 및 관절 운동 범위 제한이 가장 흔하였고 이는 수지 관절 감염 침범 여부와 연관이 있었다[
10,
11,
21]. 이번 연구에서도 초기 관절을 침범한 감염을 보인 환자에서 그렇지 않은 환자에 비해 최종 관절 운동 범위가 유의미하게 감소한 것을 확인할 수 있었다. 또한, 해당 수지의 절단은 가장 심각한 감염의 합병증으로, Reilly 등[
23]은 약 40%에서 절단술이 필요했고 증상 발생부터 수술 치료까지의 시간과 진단의 지연과 연관이 있다고 보고하였다. 하지만, 본 연구에서는 증상 발생과 본원에서의 수술 치료 사이의 기간을 3개월을 기준으로 구분하였을 때[
18], 증상 발생 후 수술까지의 기간이 절단, 관절 고정 등의 관절을 보존하지 못하게 되는 것과 유의미한 관련성을 보이지 않았다. 이에 대해서는 보다 대규모 연구를 통한 확인이 필요하겠다. 추가적으로 Francel 등[
24]은 당뇨병 및 신장기능 저하 환자에서 절단 위험도가 더 높았다고 보고한 바 있다.
여러 연구에서는 뼈 및 관절 감염에서 항균제 사용기간을 통상적으로 4–6주 정도로 추천하고 있다[
7,
25,
26]. 어떤 연구에서는 적절한 수술 치료를 전제로 통상적인 기간보다 짧게 항균제를 투약하는 것도 치료 성적이 좋다는 보고된 바 있다[
27]. 수지 골 및 관절 감염 환자에서 항균제 사용은 여전히 논란이 있으나, 일반적으로 장골 골수염의 치료 방침을 그대로 따르도록 추천하는 것이 현재의 실정이다[
7]. 수지 골 및 관절 감염에서 총 항균제 사용기간이 통상적인 4–6주보다 짧아지더라도 완치율과 재발률에 큰 차이가 없다면 재원 기간을 줄일 수 있고 약제 부작용을 줄일 수 있는 장점이 있으므로 향후 항균제 사용 기간에 대한 잘 설계된 연구가 필요하다. 또한 경구용 항균제로 변경하는 시점에 대해서도 논쟁이 있는데, 경구용 항균제 변경 가능 시점도 재원 기간에 지대한 영향을 주기 때문에 이에 대한 후속 연구가 필요하다고 하겠다.
이번 연구는 몇 가지 한계점들이 있다. 첫 번째로 총 31예의 수지 감염 환자로 연구집단의 크기가 작고 후향적으로 분석한 연구로 결과 해석에 제한이 있다. 두 번째로 수술 치료를 결정하는 기준이 술자에 따라 다양할 수 있다. 특히 연부 조직의 상태가 일차 봉합 가능한지 혹은 지연 봉합을 해야 하는지를 판단하는 것이 수술자의 주관적인 기준이라는 지적을 피하기 어렵다. 세 번째로 추시 기간이 치료 종결 후 평균 7.5개월로 짧아 장기적인 예후를 판단할 수 없다. 골수염의 경우에는 1년 이후에도 재발된 보고가 있으므로, 평균 7.5개월의 추시만으로 재발률을 판단하는 것이 무리일 수 있다. 마지막으로 수술 전 수지의 관절 운동 범위가 측정되지 않아 수지 관절의 감염이 있던 환자에서 발생한 관절 운동 범위의 제한이 감염의 후유증인지 아니면 원래 가지고 있는 기저 질환으로 인한 수지 기능의 악화인지 명확하게 구분하기 어렵다.
결론
수지 골 및 관절 감염은 다양한 병인에 의해 발생했으며 상당 수의 환자들에서 염증 지표인 ESR과 CRP가 정상이었다. 항균제와 수술 치료의 병행은 높은 치료율을 보여주었지만, 초기에 관절 감염은 수술 후 수지 관절 운동 범위에 대한 나쁜 예후 인자였다. 수지의 연부 조직 상태는 수술 치료 방법을 결정하는 데 있어 중요한 요인이었다. 심한 피부 결손이나 연부 조직 감염이 있는 경우에는 초기 수술 후 지연 봉합술을 고려해야 한다.




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download