Abstract
Adipose tissue is an ideal tissue to use as an autologous substitute with which to approach tissue deficiency. Clinically, the use of fat grafts and adipose-derived stem cells has dramatically increased worldwide for reconstructive and aesthetic purposes. Human adipose tissue contains a population of pluripotent stem cells capable of differentiating along multiple mesenchymal cell lineages. Adipose tissue is an abundant, expendable, and easily obtained tissue that may prove to be an ideal source of autologous stem cells for regenerating tissues. The recent identification and characterization of multilineage cells from human adipose tissue has been met with a great deal of excitement by the field of tissue engineering. The authors' laboratory has characterized a population of cells obtained from human adipose tissue that have the capacity to differentiate into osteoblasts, chondrocytes, adipocytes, and neuron-like cells in vitro. This article summarizes the basic study of the adipose tissue as a multipotential stem cell source of tissue engineering techniques that are currently being developed to solve common aesthetic problems.
우리 몸에서 상당부분을 차지하고 있는 연부조직인 지방조직 내에는 지방세포 외에 많은 미세혈관 내피세포, 내막세포, 섬유모세포, 근육세포, 지방전구세포로 구성된 간질혈관분획(stromal vascular fraction, SVF)으로 구성되며 최근에는 SVF에 간엽줄기세포가 포함되어 있어 적절한 환경과 생물활성 요소 물질이 영향을 주면 각기 다른 연골, 골, 근육, 지방으로 유도된다는 사실이 보고되고 있다. 따라서 성체줄기세포 중 가장 얻기 쉽고 풍부한 양을 얻을 수 있는 곳은 지방조직에서 유래하는 지방줄기세포라 할 수 있다. 이러한 이유로 최근에는 많은 연구결과가 보고되어 왔으며 다른 공급원의 성체줄기세포보다 줄기세포의 특성이나 분화능에 뒤떨어지지 않음을 또한 보고되고 있다. 무엇보다도 장점을 든다면 손쉽게 많은 양을 얻고 어느 연령층에서도 줄기세포의 특성을 유지한다는 것이다. 이들 줄기세포는 지방조직뿐만 아니라 연골, 골, 신경조직, 혈관조직 등 간엽조직 재생과 간세포, 신장, 심혈관 재생 등 다양한 조직으로 재생한다는 것이 밝혀지고 있다. 여기서는 지방조직에서 유래한 줄기세포의 기원, 세포특성과 다중분화능, 그리고 임상적응용 가능성에 대한 연구결과를 소개하고자 한다.
지방조직은 우리 몸에서 가장 많은 부분을 차지하고 있으며, 지방조직의 1/3에서 2/3 정도는 지질을 함유하는 지방세포와 나머지는 혈구세포, 혈관내피세포와 지방세포의 전구세포(preadipocyte)로 구성되어 있다[1]. 우리 몸의 에너지 저장과 대사에 관여하며 골격이나 신경, 심혈관계 주위에 존재하여 외부의 충격에 완충작용을 하는 역할과, 중요기관의 보호막 밖에서 서로 유착을 막아주는 역할을 담당한다. 또한 조직 내에 매우 풍부한 미세혈관 망을 가지고 있어 호르몬과 성장인자 등의 전달물질에 민감하게 반응하며, 외모적으로 우리 몸의 섬세한 윤곽과 형상을 유지하는 골격의 보조역할로서 매우 중요하다. 이와 같이 지방조직은 그 역할로 가지는 비중이 조직이기 보다는 하나의 거대한 기관이라 할 수 있다. 또한 최근에는 골수와 마찬가지로 지방조직 내에도 간엽줄기세포(mesenchymal stem cell)들을 가지고 있어 지방조직에서 다양한 중배엽성 조직으로 분화 유도시키는 연구가 활발하다[2]. 지방조직 내에 있는 지방전구세포도 일종의 줄기세포라 할 수 있다.
성체줄기세포는 미분화 상태로 자가증식하고 다른 조직의 세포로 다중 분화될 수 있는 세포로 우리 몸에 많은 조직에 존재한다는 것이 밝혀졌다. 그 중 가장 먼저 알려진 것은 골수에서 유래하였다. 이후 탯줄혈액뿐만 아니라 말초혈액에서 분리되며 또한 태반, 피부, 신경조직 등 우리 몸 어느 곳에서나 성체줄기세포가 존재한다. 골수줄기세포(bone marrow stem cell, BMSC)는 많은 연구를 통해 간엽줄기세포로 확인되어 왔으나 채취 시 동통, 많은 양의 줄기세포 획득이 불가한 단점이 있으며[2], 탯줄혈액 등은 적기에 얻기 힘들며 자가조직으로 사용하기에는 장기간의 보관 등의 문제점을 갖고 있다[3]. 최근 지방조직에서도 줄기세포가 존재한다는 사실의 기원은 1992년 인체지방조직에서 분리한 SVF 층에서 von Willebrand factor (vWF), a-smooth muscle cell actin과 cytokeratin에 염색된 세포인 미세혈관내피세포를 발견한 이후[4] 최근 연구에서 줄기세포와 유사한 형태의 세포가 이들 조직 내에 존재하며 이들 세포가 다중분화능을 가지는 줄기세포임을 확인하였다[256].
지방조직은 배아의 중배엽에서 기원하며, 중배엽조직의 줄기세포는 뼈, 연골, 근육, 지방조직을 생성할 수 있다. 지방조직의 줄기세포는 그동안 지방전구세포, 기질세포, processed lipoaspirate cells, multipotent adipose-derived cells, adipose derived adult stem cells 등의 이름으로 불려져 왔으며 2004년도 국제지방관련연구회(International Fat Applied Technology Society)에서 adipose-derived stem cells (ASC)로 통일하여 명명하기도 하였다[7].
지방흡입수술에서 얻은 흡입된 지방조직에서 얻어지는 지방줄기세포의 양은 300 mL 당 1×107 개에서 6×108개의 줄기세포가 분리되고[2891011] 90% 이상의 생존율을 보인다는 연구가 있으며[89] 이는 골수줄기세포에 비해 쉽게 배양되고 증식속도도 빠르고[21112] 세포노화 현상도 늦게 일어남을 보고하고 있다[3].
지방조직은 최근 비만환자에서 미용성형 목적으로 시행되고 있는 지방흡입술에 의해 얻을 수 있으며 지방흡입술은 과거 30년 전부터 안전하고 손쉬운 시술로 행하여져 왔다. 일반적으로 임상에서 이루어지는 지방흡입술은 수백 밀리리터로부터 수천 밀리리터까지 한번에 얻을 수 있다. 과거에는 이들조직들은 그냥 버려져 왔으나 최근에는 자가지방 이식용으로 임상에서 사용되며 또한 지방세포 연구자들에 의해 줄기세포를 얻는 데 활용되고 있다.
지방흡입이나 절제된 지방조직에서 줄기세포를 분리하는 방법은 여러 문헌에서 소개되고 있으나[2589], 간단히 요약해 보면 채취된 조직을 완충액으로 세척한 후 효소처리 하여 기질과 세포를 분리시킨다. 이때 부유된 조직을 원심 분리하면 상층의 세포외기질 및 기름층과 하단에 침전된 세포층으로 나누어진다. 하단에 침전된 층을 SVF로 부르며 여기에 지방줄기세포가 포함되어 있다. 침전된 세포는 배양판에 쉽게 부착되어 수일 내에 성장 증식이 일어난다. 초기의 침전세포층 내에는 혈관내피세포, 근육세포, 간극세포, 섬유모세포 그리고 혈구세포 등이 포함되나 수차례 계대 배양 후 줄기세포가 남겨진다(Figure 1) [13]. 그러나 일부 섬유모세포들도 부착되어 증식됨으로 이들 세포가 줄기세포로만 이루어 남는다는 점은 아직 논란의 여지가 있다[14]. 따라서 일부 연구자는 특이적 세포표면항원을 이용한 유세포분리기로 줄기세포를 분리하여 연구를 하기도 한다.
지방조직 내에는 줄기세포 외에 지질이 함유된 분화지방세포, 섬유모세포, 혈관내피세포, 혈관근육세포, 면역세포 등이 혼합된 세포가 존재하고 있다. 간엽줄기세포로 정의되기 위해서는 세가지 조건이 충족되어야 하는데 첫째는 배양용기에 부착하여 증식되고, 둘째는 시험관 내에서 골모세포, 지방세포, 연골모세포로 분화할 수 있어야 하며, 셋째는 특정 세포표면항원이 발현되어야 한다[15].
다분화능을 가진 ASC(지방줄기세포)는 지방세포, 골모세포, 연골모세포, 근섬유모세포 등 대부분의 중간엽 세포로 분화할 수 있다[25618192021]. Zuk 등[2]은 인체 지방조직을 지방흡입술로 채취하여 콜라겐효소로 녹인 후 원심분리(1,200 xg, 10분)하여 상층의 지방세포와 하층의 SVF 로 분리시킨 다음 하층의 SVF를 Dulbecco's modified Eagle's medium과 10% fetal bovine serum (FBS)에 배양하여 증식시킨 후 각각의 분화 유도 배양액(Table 2) [15]을 처리하여 각각의 연골, 골, 심근세포, 혈관내피세포, 근육, 지방세포를 분화시켰다. 또한 지방줄기세포는 중배엽조직 세포뿐만 아니라 외배엽조직인 신경세포로도 분화할 수 있다는 것을 생물학적 또는 조직학적 검사를 통해 확인되었다[22]. 지방조직세포가 중배엽 기원이기 때문에 ASC가 외배엽기원의 신경조직으로 분화한다는 것이 이치에 맞지 않다고 생각될 수 있다. 그러나 이 세포가 시험관 내에서 혈청이 없이 산화방지제에 노출 될 경우, 세포는 비록 신경생리학적 검사에 의해 확인되지는 않았지만, 신경세포와 같은 양극을 가진 세포모양을 보이게 된다[681416181920212324]. 또한 지방줄기세포가 혈관신생작용이나 조혈작용에도 관여 할 수 있다고 한다[2526]. 이에 대한 임상적인 연구는 제한적이지만 창상치유, 혈관생성 촉진 등 많은 시도가 이루어지고 있다.
지방신생은 연조직의 재건의 여러 분야에 쓰일 수 있다. 수천 명의 환자가 몸의 윤곽의 결손이나 주름 등에 지방이식을 받고 있다. 2008년 미국성형외과학회 통계에 의하면 미용목적으로 동 학회 회원에 의해 한 해에 46,218명이 지방주입술을 받았으며 그 시술비용으로 약 7,200만 달러가 지불되었다[27]. 지방이식은 성숙한 지방세포의 이식뿐만 아니라 ASC의 작용 또한 기대할 수 있는데, 이것은 지방세포로의 분화와 혈관 신생에도 역할을 하기 때문이다[22]. ASC를 분리하여 재주입 함으로써 지방 신생과 혈관 신생을 보강하여 이식지방의 생존율을 높일 수 있다.
외상이나 수술적인 절제에 의한 크기가 큰 연조직 결손이 임상에서는 매우 흔하다. 이러한 조직 결손된 부분을 복구하는 재건성형에 있어서 지방조직이식은 매우 중요한 부분을 차지한다. 그렇지만 이러한 큰 결손의 재건에 제공된 이식편이 생존 유지하기 위해서는 충분한 혈류의 공급이 필수적이다. 아마 조직공학적인 기술이, 예를 들어 micro-channelled hydrogel cylinder [28]나 macroporous hydrogel fragment [29]를 사용함으로써 조직내부의 혈류를 가능하게 하여 이러한 결손을 회복하는데 도움을 줄 수 있을 것이다.
실험실에서 지방세포로의 분화는 14일이 걸리며, 이후에 oil red O stain을 통해서 세포내의 지질을 볼 수 있다(Figure 3). 다능성의 줄기세포에서 지방세포 계열로의 분화에 관여하는 유전자나 factor에 대해 밝혀진 것은 없지만 인슐린과 글루코코르티코이드가 가장 중요한 자극제라는 것은 알려져 있다. 시험관 내에서 지방신생의 첫 단계는 insulin-like growth factor (IGF)-1에 의해 시작된다. 성장홀몬이나 글루코코르티코이드, 인슐린, 지방산은 모두 지방세포 분화의 초기 또는 후반 단계의 자극제이다. T3 호르몬(갑상선 호르몬)은 후반 단계에만 자극제로 작용한다[1820]. 또한 지방분화 유도 배지에는 isobutyl methyxanthine과 같은 cAMP 유도체와 이전에 언급한 factor들이 들어간다[268202430].
고농도의 retinoid나 interferon, interleukin (IL)-1, IL-2, transforming growth factor (TGF)-beta, TNF-alpha와 같은 cytokine은 모두 지방분화 유도를 강력히 억제하기 때문에 지방세포 분화를 유도하기 위한 배양액 내 첨가는 피해야할 것들이다[18]. Tumor necrosis factor-beta의 지방분화억제 효과는 단독으로도 작용하지만, IGF-1의 지방분화효과를 억제함으로써 지방신생의 억제 효과를 나타낸다. 반면에 vascular endothelial growth factor (VEGF)나 fibroblast growth factor-2, platelet derived growth factor-BB와 같은 혈관 신생에 관여된 factor를 투입할 경우 생쥐 모델에서 6주간 초기 혈관 신생과 지방조직의 성장의 향상을 나타냈다[31]. 이것은 지방줄기세포를 투여하여 지방분화유도를 증강시키는데 임상적으로 유용하게 이용될 수 있을 것이다.
완벽한 연골을 재생시킬 수 있다면 지방줄기세포를 외상성 관절이나 관절염 치료에 유용하게 사용할 수 있다. 동물실험에서 지방줄기세포는 토끼의 뼈연골 결손을 치유하는 데 사용되어 왔다[32]. 그들은 천공기로 토끼의 대퇴골 골관절돌기에 6×3×0.5 mm의 결손을 만들고, 결손부위에 지방줄기세포와 혈청섬유소로 처치하여 기존의 방법과 비교관찰한 결과 골연골 치유능력이 우수하다는 결과를 얻었다. 생체 내에서 연골재생을 촉진시키는 것이 어렵기 때문에, 연골성장에 대한 생리학적 생체 표준에 대한 보고가 없는데도 불구하고 이 결과는 희망적으로 보인다.
시험관 내 지방줄기세포의 연골분화는 인슐린, TGF-β1과 아스코빈산을 배양액에 첨가해서 유도한다[262433]. 수 주 동안 2형, 4형 콜라겐과 aggrecan이 형성할 수 있도록 세포를 칼슘 알지네이트 젤내에서 삼차원 배양할 때 연골의 세포외기질 단백질의 발현이 증강된다. 고밀도세포배양(micromass culture) 기술은 생체환경과 유사하게 만드는 방법으로 세포가 조밀한 상태에서 연골생성 결절로 분화되게 해준다[6] (Figure 4). 세포가 단층에 있을 때 분화에 관련된 유전자 발현될 수 있으나 그 농도는 미미하다[33].
임상적으로 지방줄기세포의 골모세포로의 분화는 골절 시 뼈의 불유합이나, 부정유합을 치유하는데 도움을 줄 수 있고, 골이식이나 관절융합을 도울 수도 있다. Lee 등[20]은 2003년에 시험관 내에서 지방분화줄기세포가 골모세포 계열로 분화하는 것을 확인하고 이어 생체 내에서도 골 형성을 하는 첫 증거를 제시하였다. 그들은 지방줄기세포를 흰쥐의 부고환지방조직으로부터 분리하여 세포를 분화시키고 피하지방층에 다시 재이식하여 8주째에 뼈가 형성됨을 확인하였다.
2004년에 Cowan 등[34]은 쥐에 치명적인 크기의 두개골결손을 치료함에 있어 지방줄기세포를 apatite로 코팅하고, polylactic-co-glycolic acid scaffold를 이용한 연구결과를 발표하였다. 그들은 12주째에 70-90%의 결손이 치료됨을 확인하였고 골수유래줄기세포와 지방줄기세포간의 차이가 없음을 확인하였다. 2주째에 실시한 염색체 검사에서 새로이 형성된 96 -99%의 뼈는 원래 수혜자인 수컷으로부터가 아닌 이식한 암컷 세포로부터 유래되었음을 확인하였다[34]. 어른과 2세 이상의 어린이는 큰 두개골의 결손을 치유할 능력이 없으므로 이 기술은 그 같은 상처를 치료할 능력을 가지고 있었다. 인간에게 이 같은 보고가 처음 된 것은 2004년도였다[35]. 7세 여자아이로 일년 전 심한 두부 손상과 감압적 개두술에 의한 광범위한 120 cm2의 두개골 결손을 가진 환아였다. 그녀는 15 mL의 치골로부터 나온 해면골로 치료하였고 10 mL의 지방줄기세포를 채취(세포를 처리하는 데 2시간 걸림)하여 첨가하였다. 자가혈청으로 얻은 fibrin glue와 macropore sheet가 고정을 위해 사용되었다. 3달째 실시한 컴퓨터 촬영에서 결손부위의 광범위한 골재생이 이루어져 이전에 사용하던 보호모자를 제거할 수 있었다. 이것은 안전하고 효율적인 방법이나 이 결과를 확진하기 위해서는 추가적인 임상시험이 있어야 한다.
대부분의 연구는 비록 정확한 기전은 알려져 있지만 dexamethasone이 시험관 내에서 골분화를 촉진하기 위해 필요하다는데 동의하였으며[2202430], 또 다른 연구에서는 1,25-dihydroxyvitamin D3 가 대신할 수 있음을 보고하였다[6]. 콜라겐 형성과정 중 proline과 lysine residue의 hydroxylation에 co-factor로써 관여하는 ascorbic acid가 비콜라겐성 뼈 기질단백질의 합성도 증가시킨다는 것을 확인하였다. 또한 β-glycerophsphate도 세포외기질의 석회화와 광물화에 필요한 물질이다[36]. 그러므로 골화를 촉진하기 위해 배양액내에 dexamethasone 또는 vitamin D와 더불어 ascorbate부산물과 β-glycerophsphate 등이 포함되어야 한다[26202430]. 또 다른 연구는 염소의 지방줄기세포를 성장인자인 bone morphogenic protein2 (TGF-β superfamily)와 같이 짧은 시간 동안(15분) 반응시킨 후 배양하여 지방줄기세포를 골분화 유도가 됨을 보고하였다[37]. 인간 지방줄기세포에 이용된다면 재주입 전에 그같은 간단한 선처치로 골분화 유도되는 프로토콜을 개발하는데 매력적인 방법이 될 것이다. 시험관에서는 지방줄기세포가 석회화된 세포외기질을 2% alizarin red 염색으로 골 분화된 것을 관찰하는데 걸리는 시간은 28일 이상이다(Figure 5).
지방줄기세포가 5% 말 혈청과 글루코코르트코이드(예를 들면 hydrocorisone, dexamethasone)가 있는 배양액에서 골격근과 민무늬근육세포으로 분화될 수 있다. 이 환경에서 배양되었을 때, 세포들이 융합해서 근세포에 대한 단백질 표지자를 생성하는 다핵 근관(myotube)을 형성한다고 보고되어 왔다[2624]. 그러나 근세포 분화는 모든 분화된 세포에서 가장 낮은 산출률과 재현율을 나타내었다[22].
Rodriguez 등[38]은 정상인의 ASC를 dystrophin이 결손된 면역적격 생쥐(Duchennes 근이영양증의 동물모델)의 앞 정강근에 주입하여 줄기세포에 의해 근육이 융합됨을 발표하였다. 주입 10일 후 처치받은 근섬유의 50%에서 dystrophin이 검출되었고, 6개월에는 90%가 검출되었다. 흥미롭게도, 50일까지 dystrophin 양성 근섬유가 인접 장딴지근에서 보였다. 이것은 주입한 곳에서 다른 근육으로 세포가 이동했다는 것을 나타낸다.
지방줄기세포가 외배엽성인 신경조직으로 분화된다는 연구결과도 있지만 아직까지 신경지지 간엽조직으로 분화되는지 신경조직 자체로 분화유도 되는지는 논란이 많다. 중추신경계 재생에 대한 연구는 주로 골수줄기세포를 이용하여 왔고 일부 지방줄기세포를 이용한 말초신경 재생에 대한 연구도 있다. 이에 대한 연구는 지방줄기세포를 신경성분화 유도물질이 함유된 단층배양 배지에서 신경세포 분화를 유도한 후, 역상 현미경으로 신경세포 형태로 분화된 세포들을 관찰하였다[39] (Figure 6). NeuN 항체는 신경세포에 S100, p75 항체는 지지세포에 각각 반응하여 신경세포와 지지세포로 분화되었음을 확인하였다. 또한 흰쥐의 좌골 신경에 15 mm의 결손을 만들어 실리콘 관으로 연결시킨 후, 지방줄기세포에서 분화된 신경 기간세포를 콜라겐 겔에 섞어 관 안에 이식하여 4 주와 8 주에 조직학적으로 신경재생이 우월하였으며 근전도를 통한 신경전달속도도 대조군보다 빠르게 기능이 회복됨을 보고하여 지방줄기세포가 신경분화에도 관여함을 알 수 있었다[39].
지방조직으로부터 얻어진 세포군들이 여러 가지 세포가 섞여있는 것이기 때문에 지방줄기세포가 혈관 신생에 도움이 된다는 것을 지지하는 문헌을 찾아보는 것은 쉽지 않은 일이다. 1990년대 초반 vWF 염색과 CD31 항원과 반응하는 것으로 알려진 내피세포에 특정한 항원 EN4의 발현에 근거하여 지방흡입물(lipoaspirate)을 분석한 연구 결과 SVF의 주요한 세포 유형은 혈관내피세포라고 알려져 왔다[40]. 그러한 세포를 함유하는 돼지의 복막지방조직을 배양하여 polytetrafluoroethylene 인조혈관에 부착시켜 이식하였다[4]. 이 연구에서 이식혈관에 부착된 세포 결과는 내피세포화를 의미하지만 연구에 사용된 세포는 SVF 전체를 사용하였기 때문에 내피세포의 기원은 지방줄기세포에서 발생한 것으로 보는 것보다는 SVF로 보는 것이 옳은 것으로 여겨진다. 지방줄기세포가 혈관이식조직(vascular graft)의 patency와 장기간 결과에 유용한 지의 여부에 대해서는 추가적인 연구가 필요하다[21].
최근 들어 flow cytometry를 사용하여 세포 표면 표지자(cell surface marker)를 이용하여 지방줄기세포의 혈관 신생 능력에 관련된 각각의 세포 계열의 존재와 분포를 정의하기 위한 연구를 하고 있다. 지방줄기세포는 CD14, CD16, CD56, HLA-DR/MHC class II, CD45와 같은 조혈모세포 표면항원을 발현하지 않을 뿐만 아니라, 백혈구, 내피세포의 항원인 CD31을 공유하지도 않는 것으로 알려지고 있다[68194142].
조혈모줄기세포에 의해서 발현되는 것으로 알려진 CD 34의 발현은 논란의 여지가 있다. 초기에는 CD34가 지방줄기세포의 표지 항원이 아니라고 알려져 왔지만 최근 유명 지방줄기세포 연구팀에 의하면 여러 가지 정도의 차이는 있지만 존재할 수 있다는 가능성을 보고하였다[543]. 현재로서는 지방줄기세포가 SVF 처리과정에서 발현되는 CD34+ 라고 생각되지만 시험관 배양을 하면서 소멸된다고 보고하고 있다[44].
지방줄기세포는 대식 세포 군집 자극 요인(macrophage colony-stimulating factor)과 과립성 백혈구 대식 세포 군집 자극 요인(granulocyte-macrophage colony-stimulating factor)을 포함한 다양한 조혈 세포 사이토카인을 발현하고 분비한다[19]. 또한 혈관 유리 성장 요인(VEGF)과 간세포 성장 요인(hepatocyte growth factor), TGF-beta를 포함한 anti-apoptotic factor와 혈관 신생 요인(angiogenic factor)을 분비한다는 근거도 있다[2645]. 산소가 적은 상황에서 VEGF의 분비가 현격하게 증가하게 되고 이는 내피세포의 숫자를 증가시키고 세포사멸은 낮추는 자극을 주게 한다[26]. Nude mice의 하지허혈 모델을 가지고 생체 내 실험을 한 결과 지방줄기세포를 주입한 결과 사지(limb)의 혈류량과 모세혈관 밀도와 관련하여 순환이 현격하게 개선되었다[2526]. ASC가 신생혈관에 결합하는 것으로 이러한 변화를 설명할 수 있다. 또한 ASC가 분화한 것이 내피세포가 된다는 가설보다는 ASC가 VEGF와 같은 요인을 분비함으로써 혈관신생을 촉진시키는 역할이라는데 무게를 두고 있다[2526].
흉벽의 osteoradionecrosis처럼 방사선치료와 관련된 합병증이 발생한 20명의 환자를 대상으로 자가 지방에서 분리한 SVF를 병변에 주사하는 연구결과에서 모든 환자는 신생혈관 형성과 수화(hydration)작용이 진행하면서 조직이 점차 재생하는 치료효과를 얻었다[42]. 매우 놀라운 결과를 얻은 반면에 이 연구에서 주입한 지방조직에는 다른 많은 세포유형이 섞여 있기 때문에 ASC의 역할에 대해서는 여전히 불분명한 면이 있다. 그럼에도 불구하고 이러한 형태의 치료는 미세혈관 병리의 유용한 최소 침습 치료로서 여러 가지 가능성이 있다.
ASC의 조혈능력을 연구하기 위하여 2003년에 치사량에 가까운 방사선을 쥐에 조사하여 이를 BMSC가 아니라 ASC를 사용하여 재건하는 작은 동물실험이 실행되었다[41]. 당일 복강 내로 ASC를 주입한 결과 40%의 쥐가 생존하였다. BMSC를 복강 내로 주입한 결과도 40%의 생존율을 보였다는 점에서 이 연구는 의미가 있다. 하지만 BMSC와 비교하여 ASC의 경우 재건속도가 느렸으며 BMSC 이식의 가장 효과적인 방법은 정맥내주사였고, ASC를 정맥 내로 주사한 결과는 좋지 않았다. 이 연구에서 지방줄기세포의 효과는 다분화능 조혈줄기세포의 증식을 촉진시키고 결과적으로 내인성(endogenous) 조혈작용을 돕는 역할이 있다고 결론을 내렸다[41].
지방줄기세포의 기타 임상적용으로 크론씨병의 만성 누(fistula)치료에 지방줄기세포가 임상시험되었다[46]. 2003년도에 자가지방줄기세포를 이용하여 크론씨병의 직장질루를 성공적으로 치료한 후[47], 제1상 임상시험이 마드리드에 있는 La Paz 대학병원에서 시도되었다. 4명의 환자에서 9개의 누가 있었는데 배양된 지 6일에서 31일 된 지방줄기세포를 투여 하였다. 일주일 간격으로 8개의 누를 추적관찰 하였는데 이전에 내과적인 치료와 외과적인 치료에 모두 반응이 없었음에도 불구하고 6개의 누가 8주안에 완전히 치료되었다. 부작용은 전혀 관찰되지 않았고, 저자들은 줄기세포투여가 안전하며, 효과적이고, 제2상 임상시험으로 진행해도 정당화될 수 있다고 결론을 내렸다.
지방줄기세포 관련 문헌에 대한 현재의 가장 큰 논점 중 하나는, 대부분의 연구는 지방줄기세포의 배양을 개시하기 위해 지방 유래 SVF 세포의 bulk culture를 이용한다는 점 등, 연구의 표준화가 부족하다. 이전에 언급한 것과 같이 SVF가 이종세포의 혼합물임에도 불구하고, 이 세포들 중 작은 비율만이 계속해서 플라스틱 배양접시에 부착하고 증식한다. 문헌에 보고된 많은 실험들은 지방줄기세포의 명확한 표지인자가 부재된 상태에서 지방줄기세포를 포함하고 있기는 하지만 그것만으로 구성되지는 않은 혼합 세포군이 사용되었을 가능성이 남아있다.
지방줄기세포가 일상적인 임상치료에 이용될 수 있게 되기까지는 다수의 시련이 남아있다. 지방줄기세포에 특이적인 표지인자의 발견은 줄기세포 분화 연구에 결정적으로 가속화할 것이고, 결과적으로는 지방줄기세포를 신속하게 정제할 수 있도록 함으로써, 세포배양 없이 즉시 임상에 이용이 가능하게 될 수도 있다. 따라서 지방줄기세포 분화를 위한 신뢰성이 높고, 빠르고, 효율적인 기법이 또한 필요하다. 현재 지방조직 형성은 대략 2주 내에 일어나 타 조직 분화에 비해 상대적으로 빠른 양상을 보이지만, 연골 형성과 골 형성은 지방 형성되는 유사한 기법을 사용하더라도 상당히 오랜 시간이 걸리고 세포 회수율도 아직 낮다. 최근 조직공학기법을 이용하여 생체 내 환경과 유사한 조건을 갖춘 생분해성 인공지지체에서 줄기세포를 증식시키고 원하는 조직으로 분화를 유도하면 보다 빠른 재생조직을 형성 시킬 수 있을 것이다. 이는 세포를 다양한 사이토카인이나 성장인자들로 전 처리함으로써 달성 가능할 수도 있다. 앞서 언급한 세포계의 삼차원배양을 위한 유용하고 신뢰성 높은 기질을 발견하는 것은 임상적으로 유용할 것이다. 표면 수용체에 관한 지식, 생분해성 인공세포외기질과 생물학적 성장인자 등의 구성요소들에 의해 줄기세포의 분화 정도를 확인 한다면 시험관 내 배양을 촉진 할 뿐만 아니라 배양과정을 거치지 않아도 직접 생체이식이 가능하리라 본다. 지방줄기세포는 현재 소 혈청을 포함하는 배지에서 배양되기 때문에, 일반적으로 사용되는 세포배양기법을 이용할 경우, 배양 배지에서 인간의 지방줄기세포로 감염이 전염될 위험성이 있다. 혈청이 없는 배지에서 세포를 분화시키는 능력 또한 임상적 이용 전 세포가 오염될 위험성을 낮추는 데 바람직할 것이다.
지방줄기세포 이식의 안전성과 신뢰성이 확립되기 위해서는, 동물 모델을 이용한 생체 내 실험결과의 일관성과 높은 신뢰성이 확증되어야 할 것이다.
인간 내에서의 지방줄기세포의 안전성을 인정하는 임상증례가 때때로 보고되고 있지만[3344], 안전성뿐만 아니라 유효성까지 확립하기 위해서는 대규모의 임상시험이 필요할 것이다. 근래의 몇몇 연구들은 이식된 지방줄기세포에서 면역억제 특성을 발견하였다[3843]. 국소적 면역억제는 일부 환경에서는 유용한 특성이 될 수 있지만, 숨겨진 암 조직이 면역 감시를 피할 수 있게 하는 등 확실히 잠재적 위험성을 지니고 있다[22]. 대규모의 시험들만이 지방줄기세포의 진정한 risk/benefit 비율을 명확히 드러낼 수 있을 것이다. 이러한 논평들에도 불구하고, 이들 논점 중 많은 수가 현재 논의되고 있고, 빠른 진전이 예상된다. 수확, 정제, 배양방법이 용이할 뿐만 아니라 많은 양을 얻을 수 있어 지방줄기세포는 미래에 임상치료에 광범위하게 적용될 수 있을 것으로 전망된다.
본 논문은 성체줄기세포 연구의 핵심이라 할 수 있는 지방줄기세포의 분리방법과 특성, 임상적용과 문제점 그리고 미래예측에 대해서 기술하고 있다. 성체줄기세포에 대한 기본적인 이해에서부터 연구에 직접 참여하는 연구자에게도 깊이 있는 정보를 제공하는 매우 포괄적이면서도 핵심적인 논점을 잘 서술하고 있는 논문이다. 임상의학자의 입장에서 임상적용이라는 최종의 목표를 향해서 반드시 연구되어져야 할 요소들이 세포의 획득과정과 정제과정 그리고 각종 세포로 분화되는 과정에 조목조목 지적되고 있다. 줄기세포에 대한 막연한 기대와 과잉 홍보, 심지어 상업화를 우려하는 시점에 지방줄기세포연구에 매진한 필자가 필자의 연구경험과 성과뿐만 아니라 지금까지 연구된 내용들을 잘 정리하고 객관적으로 전달함으로써 독자들에게 매우 유용하고 성체줄기세포에 대한 균형 된 시각을 가지게 할 것으로 기대된다.
[정리: 편집위원회]
Figures and Tables
Figure 1
Summary of cycle of human adipose-derived stem cell (ASC) isolation and differentiation for clinical usage. SVF, stromal vascular fraction (From Locke M, et al. ANZ J Surg 2009;79:235-244, according to the Creative Commons Attribution License) [13].
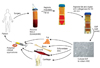
Figure 2
Immunophenotype of adipose stem cell. Adipose derived stem cell types (P5) were stained with antibodies against the indicated antigens, and analysed by flow cytometry. Representative histograms are shown as green line and the respective isotype controls are shown as black line (From Dominici M, et al. Cytotherapy 2006;8:315-317, according to the Creative Commons Attribution License) [15].

Figure 3
Inverted microscopic finding of adipogenic differentiation from adipose derived stem cell (no stain, ×200). (A) undifferentiated adipose derived stem cell, (B) Differentiated adipose derived stem cell (matured adipocyte).
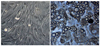
Figure 4
Chondrogenic differentiation from adipose derived stem cell. Alcian blue stain. (A)×100, (B)×400.
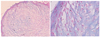
Figure 5
Inverted microscopic finding of osteogenic differentiation from adipose derived stem cell. Immunehistochemical stain of alkaline phosphatase activity (×100). (A) 2 weeks after cultured in osteogenic media, (B) 4 weeks.

Figure 6
Inverted microscopic finding of neurogenic differentiation from adipose derived stem cell (no stain, ×200). (A) No treatment, (B) 3 hours after treatment by induction medium, (C) 24 hours after, (D) 3 days after.
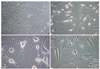
Table 1
Summary of criteria to identify mesenchymal stem cell

From Dominici M, et al. Cytotherapy 2006;8:315-317, according to the Creative Commons Attribution License [15].
Table 2
Lineage-specific differentiation induced by media supplementation
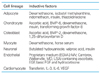
BMP, bone morphogenetic protein; EGF, epidermal growth factor; FGF, fibroblast growth factor; IL, interleukin; VEGF, vascular endothelial growth factor.
From Dominici M, et al. Cytotherapy 2006;8:315-317, according to the Creative Commons Attribution License [15].
References
2. Zuk PA, Zhu M, Mizuno H, Huang J, Futrell JW, Katz AJ, Benhaim P, Lorenz HP, Hedrick MH. Multilineage cells from human adipose tissue: implications for cell-based therapies. Tissue Eng. 2001. 7:211–228.

3. Kern S, Eichler H, Stoeve J, Kluter H, Bieback K. Comparative analysis of mesenchymal stem cells from bone marrow, umbilical cord blood, or adipose tissue. Stem Cells. 2006. 24:1294–1301.
4. Young C, Jarrell BE, Hoying JB, Williams SK. A porcine model for adipose tissue-derived endothelial cell transplantation. Cell Transplant. 1992. 1:293–298.
5. Gronthos S, Franklin DM, Leddy HA, Robey PG, Storms RW, Gimble JM. Surface protein characterization of human adipose tissue-derived stromal cells. J Cell Physiol. 2001. 189:54–63.

6. Zuk PA, Zhu M, Ashjian P, De Ugarte DA, Huang JI, Mizuno H, Alfonso ZC, Fraser JK, Benhaim P, Hedrick MH. Human adi-pose tissue is a source of multipotent stem cells. Mol Biol Cell. 2002. 13:4279–4295.

7. Zuk PA. Consensus statement. International Fat Applied Technology Society 2nd international meeting. 2004. Pittsburg: International Fat Applied Technology Society.

8. Aust L, Devlin B, Foster SJ, Halvorsen YD, Hicok K, du Laney T, Sen A, Willingmyre GD, Gimble JM. Yield of human adipose-derived adult stem cells from liposuction aspirates. Cytotherapy. 2004. 6:7–14.

9. Boquest AC, Shahdadfar A, Brinchmann JE, Collas P. Isolation of stromal stem cells from human adipose tissue. Methods Mol Biol. 2006. 325:35–46.

10. Parker AM, Katz AJ. Adipose-derived stem cells for the regeneration of damaged tissues. Expert Opin Biol Ther. 2006. 6:567–578.

11. Mitchell JB, McIntosh K, Zvonic S, Garrett S, Floyd ZE, Kloster A, Di Halvorsen Y, Storms RW, Goh B, Kilroy G, Wu X, Gimble JM. Immunophenotype of human adipose-derived cells: temporal changes in stromal-associated and stem cell-associated markers. Stem Cells. 2006. 24:376–385.

12. Sommer B, Sattler G. Current concepts of fat graft survival: histology of aspirated adipose tissue and review of the literature. Dermatol Surg. 2000. 26:1159–1166.

13. Locke M, Windsor J, Dunbar PR. Human adipose-derived stem cells: isolation, characterization and applications in surgery. ANZ J Surg. 2009. 79:235–244.

14. Safford KM, Rice HE. Stem cell therapy for neurologic disorders: therapeutic potential of adipose-derived stem cells. Curr Drug Targets. 2005. 6:57–62.

15. Dominici M, Le Blanc K, Mueller I, Slaper-Cortenbach I, Marini F, Krause D, Deans R, Keating A, Prockop Dj, Horwitz E. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy. 2006. 8:315–317.

16. Gimble J, Guilak F. Adipose-derived adult stem cells: isolation, characterization, and differentiation potential. Cytotherapy. 2003. 5:362–369.

17. Strem BM, Hicok KC, Zhu M, Wulur I, Alfonso Z, Schreiber RE, Fraser JK, Hedrick MH. Multipotential differentiation of adipose tissue-derived stem cells. Keio J Med. 2005. 54:132–141.

18. Boone C, Mourot J, Gregoire F, Remacle C. The adipose conversion process: regulation by extracellular and intracellular factors. Reprod Nutr Dev. 2000. 40:325–358.

19. Wickham MQ, Erickson GR, Gimble JM, Vail TP, Guilak F. Multipotent stromal cells derived from the infrapatellar fat pad of the knee. Clin Orthop Relat Res. 2003. (412):196–212.

20. Lee JA, Parrett BM, Conejero JA, Laser J, Chen J, Kogon AJ, Nanda D, Grant RT, Breitbart AS. Biological alchemy: engineering bone and fat from fat-derived stem cells. Ann Plast Surg. 2003. 50:610–617.

21. Gimble JM, Guilak F. Differentiation potential of adipose derived adult stem (ADAS) cells. Curr Top Dev Biol. 2003. 58:137–160.

22. Tholpady SS, Llull R, Ogle RC, Rubin JP, Futrell JW, Katz AJ. Adipose tissue: stem cells and beyond. Clin Plast Surg. 2006. 33:55–62. vi

23. Short B, Brouard N, Occhiodoro-Scott T, Ramakrishnan A, Simmons PJ. Mesenchymal stem cells. Arch Med Res. 2003. 34:565–571.

25. Miranville A, Heeschen C, Sengenes C, Curat CA, Busse R, Bouloumie A. Improvement of postnatal neovascularization by human adipose tissue-derived stem cells. Circulation. 2004. 110:349–355.

26. Rehman J, Traktuev D, Li J, Merfeld-Clauss S, Temm-Grove CJ, Bovenkerk JE, Pell CL, Johnstone BH, Considine RV, March KL. Secretion of angiogenic and antiapoptotic factors by human adipose stromal cells. Circulation. 2004. 109:1292–1298.

27. American Society for Aesthetic Plastic Surgery. Cosmetic surgery quick facts: 2008 ASAPS statistics [Internet]. 2009. cited 2012 May 18. New York: American Society for Aesthetic Plastic Surgery;Available from: http://www.surgery.org.
28. Stosich MS, Bastian B, Marion NW, Clark PA, Reilly G, Mao JJ. Vascularized adipose tissue grafts from human mesenchymal stem cells with bioactive cues and microchannel conduits. Tissue Eng. 2007. 13:2881–2890.
29. Halberstadt C, Austin C, Rowley J, Culberson C, Loebsack A, Wyatt S, Coleman S, Blacksten L, Burg K, Mooney D, Holder W Jr. A hydrogel material for plastic and reconstructive applications injected into the subcutaneous space of a sheep. Tissue Eng. 2002. 8:309–319.

30. Kim DH, Je CM, Sin JY, Jung JS. Effect of partial hepatectomy on in vivo engraftment after intravenous administration of human adipose tissue stromal cells in mouse. Microsurgery. 2003. 23:424–431.

31. Rophael JA, Craft RO, Palmer JA, Hussey AJ, Thomas GP, Morrison WA, Penington AJ, Mitchell GM. Angiogenic growth factor synergism in a murine tissue engineering model of angiogenesis and adipogenesis. Am J Pathol. 2007. 171:2048–2057.

32. Nathan S, Das De S, Thambyah A, Fen C, Goh J, Lee EH. Cell-based therapy in the repair of osteochondral defects: a novel use for adipose tissue. Tissue Eng. 2003. 9:733–744.

33. Winter A, Breit S, Parsch D, Benz K, Steck E, Hauner H, Weber RM, Ewerbeck V, Richter W. Cartilage-like gene expression in differentiated human stem cell spheroids: a comparison of bone marrow-derived and adipose tissue-derived stromal cells. Arthritis Rheum. 2003. 48:418–429.

34. Cowan CM, Shi YY, Aalami OO, Chou YF, Mari C, Thomas R, Quarto N, Contag CH, Wu B, Longaker MT. Adipose-derived adult stromal cells heal critical-size mouse calvarial defects. Nat Biotechnol. 2004. 22:560–567.

35. Lendeckel S, Jodicke A, Christophis P, Heidinger K, Wolff J, Fraser JK, Hedrick MH, Berthold L, Howaldt HP. Autologous stem cells (adipose) and fibrin glue used to treat widespread traumatic calvarial defects: case report. J Craniomaxillofac Surg. 2004. 32:370–373.

36. Duplomb L, Dagouassat M, Jourdon P, Heymann D. Differentiation of osteoblasts from mouse embryonic stem cells without generation of embryoid body. In Vitro Cell Dev Biol Anim. 2007. 43:21–24.

37. Knippenberg M, Helder MN, Zandieh Doulabi B, Wuisman PI, Klein-Nulend J. Osteogenesis versus chondrogenesis by BMP-2 and BMP-7 in adipose stem cells. Biochem Biophys Res Commun. 2006. 342:902–908.

38. Rodriguez AM, Pisani D, Dechesne CA, Turc-Carel C, Kurzenne JY, Wdziekonski B, Villageois A, Bagnis C, Breittmayer JP, Groux H, Ailhaud G, Dani C. Transplantation of a multipotent cell population from human adipose tissue induces dystrophin expression in the immunocompetent mdx mouse. J Exp Med. 2005. 201:1397–1405.

39. Jun YJ, Rhie JW, Choi YS, Kim YJ, Kim SE, Lee JI, Han KT. The effects of adipose derived stem cells on neurogenic differentiation and induction of nerve regeneration. J Korean Soc Plast Reconstr Surg. 2006. 33:205–212.

40. Williams SK, Wang TF, Castrillo R, Jarrell BE. Liposuction-derived human fat used for vascular graft sodding contains endothelial cells and not mesothelial cells as the major cell type. J Vasc Surg. 1994. 19:916–923.

41. Cousin B, Andre M, Arnaud E, Penicaud L, Casteilla L. Reconstitution of lethally irradiated mice by cells isolated from adipose tissue. Biochem Biophys Res Commun. 2003. 301:1016–1022.

42. Rigotti G, Marchi A, Galie M, Baroni G, Benati D, Krampera M, Pasini A, Sbarbati A. Clinical treatment of radiotherapy tissue damage by lipoaspirate transplant: a healing process mediated by adipose-derived adult stem cells. Plast Reconstr Surg. 2007. 119:1409–1422.

43. Puissant B, Barreau C, Bourin P, Clavel C, Corre J, Bousquet C, Taureau C, Cousin B, Abbal M, Laharrague P, Penicaud L, Casteilla L, Blancher A. Immunomodulatory effect of human adipose tissue-derived adult stem cells: comparison with bone marrow mesenchymal stem cells. Br J Haematol. 2005. 129:118–129.

44. Boquest AC, Shahdadfar A, Fronsdal K, Sigurjonsson O, Tunheim SH, Collas P, Brinchmann JE. Isolation and transcription profiling of purified uncultured human stromal stem cells: alteration of gene expression after in vitro cell culture. Mol Biol Cell. 2005. 16:1131–1141.

45. Cao Y, Sun Z, Liao L, Meng Y, Han Q, Zhao RC. Human adi-pose tissue-derived stem cells differentiate into endothelial cells in vitro and improve postnatal neovascularization in vivo. Biochem Biophys Res Commun. 2005. 332:370–379.

46. Garcia-Olmo D, Garcia-Arranz M, Herreros D, Pascual I, Peiro C, Rodriguez-Montes JA. A phase I clinical trial of the treatment of Crohn's fistula by adipose mesenchymal stem cell transplantation. Dis Colon Rectum. 2005. 48:1416–1423.

47. Garcia-Olmo D, Garcia-Arranz M, Garcia LG, Cuellar ES, Blanco IF, Prianes LA, Montes JA, Pinto FL, Marcos DH, Garcia-Sancho L. Autologous stem cell transplantation for treatment of rectovaginal fistula in perianal Crohn's disease: a new cell-based therapy. Int J Colorectal Dis. 2003. 18:451–454.

48. Kang SK, Lee DH, Bae YC, Kim HK, Baik SY, Jung JS. Improvement of neurological deficits by intracerebral transplantation of human adipose tissue-derived stromal cells after cerebral ischemia in rats. Exp Neurol. 2003. 183:355–366.





 PDF
PDF ePub
ePub Citation
Citation Print
Print


 XML Download
XML Download